
铝-空气海水电池:以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。
电池总反应为4Al+3O2+6H2O===4Al(OH)3
负极:________________________________________________________________________;
正极:________________________________________________________________________。
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
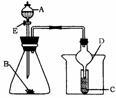
用如下图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述错误的是
A.若A为醋酸,B为大理石粉末,C为盛苯酚钠溶液,则C中溶液变浑浊。
B.若A为食盐水,B为电石,C中盛KMnO4溶液,则C中溶液褪色。
C.若A为浓氨水,B为生石灰,C中盛AgNO3溶液,则C中无现象。
D.实验中仪器D可起到防倒吸的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A广泛用于涂料、油墨、胶黏剂、医药及农药中间体领域。
已知:有机物A的仪器分析如下:
|
|
|
|
| ③ 有机物A的核磁共振氢谱图上有2个吸收峰,峰面积之比是1︰1。 |
回答下列问题:
(1)A的相对分子质量是 ;
(2)A含有官能团的名称是___________;
(3)A与氢氧化钠溶液在加热条件下反应的化学方程式是
;
(4)A有多种同分异构体,其中能与新制Cu(OH)2共热,产生红色沉淀的有 种,
写出其中任意一种同分异构体的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图所示的四个原电池装置,其中结论正确的是( )
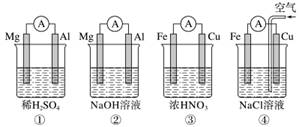
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应式,负极________________________________________________________________________,
正极________________________________________________________________________,
并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下图,下列判断中正确的是( )

A.烧杯a中的溶液pH降低
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2↑
D.烧杯b中发生的反应为2Cl--2e-===Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是( )
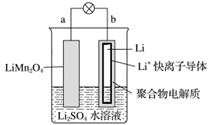
A.a为电池的正极
B.电池充电反应为LiMn2O4===Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
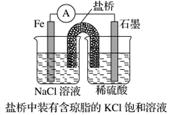
①某原电池装置如图所示,上图右侧烧杯中的电极反应式为____________,左侧烧杯中的c(Cl-)____________(填“增大”、“减小”或“不变”)。
②已知下图甲、乙两池的总反应式均为Fe+H2SO4===FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料(填“Fe”或“C”)。
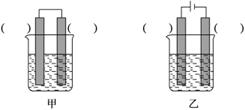
(2)用高铁(Ⅵ)酸盐设计的高铁(Ⅵ)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应为3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH。
①写出正极反应式:____________________________________________________。
②用高铁(Ⅵ)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当电池中有0.2 mol K2FeO4反应时,则在电解池中生成H2________ L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关粒子半径的叙述正确的是
A、电子层结构相同的粒子随核电荷的递增半径逐渐增大
B、CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大
C、S2-半径小于硫原子半径
D、无法比较K+、Al3+ 、O2- 、Cl-的半径大小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com