
| A. | 0.1mol/L的Na2CO3溶液中:c(CO32-)═2c(HCO3-)+c(H+)-c(OH-) | |
| B. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) | |
| C. | 向3.0L0.1mol/LNaOH溶液中缓慢通入CO2至溶液增重8.8g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 等物质的量的CH3COOH、CH3COONa混合溶液PH=4.75中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
分析 A.0.1mol/L的Na2CO3溶液中存在物料守恒和电荷守恒;
B.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中存在物料守恒,2n(Cl)=n(C);
C.NaOH溶液中缓慢通入CO2至溶液增重8.8g是增重的二氧化碳质量物质的量=$\frac{8.8g}{44g/mol}$=0.2mol,n(NaOH)=0.3mol,n(CO2)=0.2mol,依据二氧化碳和氢氧化钠溶液反应的定量关系分析判断产物,比较离子浓度大小;
D.等物质的量的CH3COOH、CH3COONa混合溶液PH=4.75溶液先酸性说明醋酸电离大于醋酸根离子水解;
解答 解:A.Na2CO3在溶液中的行为来分析:Na2CO3 =2Na++CO32-;CO32-+H2O?HCO3-+OH-; HCO3-+H2O?H2CO3+OH-;H2O?H++OH-;
由于CO32-水解后的存在形式为CO32-、HCO3-、H2CO3,根据物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),液呈电中性可知:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故A错误;
B.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中存在物料守恒,2n(Cl)=n(C),2c(HClO)+2c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3),故B错误;
C.NaOH溶液中缓慢通入CO2至溶液增重8.8g是增重的二氧化碳质量物质的量=$\frac{8.8g}{44g/mol}$=0.2mol,n(NaOH)=0.3mol,n(CO2)=0.2mol,依据二氧化碳和氢氧化钠溶液反应的定量关系分析判断得到产物,2CO2+3NaOH=Na2CO3+NaHCO3+H2O,得到等物质的量的碳酸钠和碳酸氢钠会很容易,碳酸钠水解大于碳酸氢钠,比较离子浓度大小c(Na+)>c(HCO3-)>c(CO32-)>c(H+),故C错误;
D.等物质的量的CH3COOH、CH3COONa混合溶液PH=4.75溶液先酸性说明醋酸电离大于醋酸根离子水解,电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)>c(CH3COOH),得到c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较,物理守恒分析判断,化学反应产物的定量判断,盐类水解的应用,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )
工业上采用NH3作还原剂脱氮原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3HO(g),烟气以一定的流速通过,测量不同温度下逸出气体中氮氧化物含量,从而确定烟气效率,右图是两种不同催化剂的脱氮效率曲线,判断以下分析不正确的是( )| A. | 上述反应的正反应为放热反应 | |
| B. | 催化剂①、②分别适合于250℃和450℃左右脱氮 | |
| C. | 曲线①、②最高点表示此时平衡转化率最高 | |
| D. | 相同条件下,改变压强对脱氮率没有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S、Cl、O、F的原子半径依次减小 | |
| B. | Na、Mg、Al、Si的失电子能力依次增强 | |
| C. | C、N、O、F的气态氢化物的稳定性依次增强 | |
| D. | Si、P、S、Cl的最高价含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室利用锌片和稀硫酸制H2时,在稀硫酸中滴加MgSO4溶液可以加快反应速率 | |
| B. | 将反应2FeCl3+Cu═2FeCl2+CuCl2设计为原电池,正极反应为Cu-2e-═Cu2+ | |
| C. | 利用电解法除去酸性废水中的CN-离子,CN-在阳极被还原为N2和CO2 | |
| D. | 利用电解法精炼铜,原粗铜中的杂质有以离子形式被除去,也有以单质形式被除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
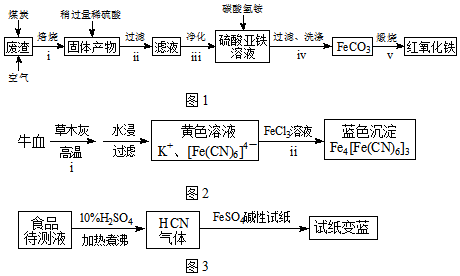
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制氯气时,用铜片作阳极 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 在铁制品上镀银时,铁制品与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将洁净的铜丝在酒精灯外焰灼烧后慢慢移向内焰 | 验证铜可作为乙醇氧化为乙醛的催化剂 |
| B | 向饱和碳酸钠溶液中通入CO2 | 比较相同温度下碳酸钠和碳酸氢钠的溶解度 |
| C | 用锌片和稀硫酸制备H2时,滴加几滴Cu(NO3)2溶液 | 加快制备H2的反应速率 |
| D | 向5mL0.1mol•L-1KI溶液中滴入0.1mol•L-1FeCl3溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 | 验证Fe3+与I-的反应可逆 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 胆矾 | 水蒸气 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com