
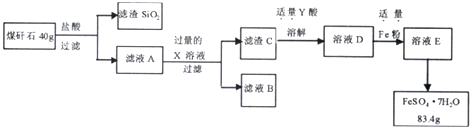
���� SiO2�������Ӧ��ú��ʯ�������ᣬ��ҺA�к����Ȼ������Ȼ�������A�м��������ǿ�������������Һ���ɵõ���ҺB����AlO2-������C��������������Ȼ�����ϡ���ᣬ�õ�DΪ���������������ۣ���ҺEΪ�����������������ᾧ�õ�FeSO4•7H2O��
��1�����˲�����Ҫ�õ��IJ������������ձ�����������©����������
��2�������Ϸ�����֪XΪNaOH��KOH��YΪH2SO4��
��3����ҺA�к����Ȼ������Ȼ�������A�м��������ǿ��Դ��жϣ�
��4���÷����ΪNa2SiO3��
��5��DΪ���������������ۣ���ҺEΪ����������
��6�������漰��ӦΪFe+2Fe3+=3Fe2+����Ϸ���ʽ���㣮
��� �⣺SiO2�������Ӧ��ú��ʯ�������ᣬ��ҺA�к����Ȼ������Ȼ�������A�м��������ǿ�������������Һ���ɵõ���ҺB����AlO2-������C��������������Ȼ�����ϡ���ᣬ�õ�DΪ���������������ۣ���ҺEΪ�����������������ᾧ�õ�FeSO4•7H2O��
��1�����˲�����Ҫ�õ��IJ������������ձ�������������©�����ʴ�Ϊ��©����
��2�������Ϸ�����֪XΪNaOH��KOH��YΪH2SO4���ʴ�Ϊ��NaOH��KOH��H2SO4��
��3����ҺA�к����Ȼ������Ȼ�������A�м��������ǿ���ҺB�к���������ΪAlO2-��Cl-��OH-���ʴ�Ϊ��AlO2-��Cl-��OH-��
��4������SiO2����ȡľ�ķ�������÷�����Ļ�ѧʽΪNa2SiO3���ʴ�Ϊ��Na2SiO3��
��5��DΪ���������������ۣ���ҺEΪ�������������ӷ���ʽΪFe+2Fe3+=3Fe2+���ʴ�Ϊ��Fe+2Fe3+=3Fe2+��
��6�������漰��ӦΪFe+2Fe3+=3Fe2+��n��FeSO4•7H2O��=$\frac{83.4g}{278g/mol}$=0.3mol��
��n��Fe3+��=0.2mol��Fe2O3�����ʵ���Ϊ0.1mol��
����ԭ40gú��ʯ��Fe2O3����������Ϊ$\frac{0.1mol��160g/mol}{40g}��100%$=40%��
�ʴ�Ϊ��40%��
���� �����Թ�������Ϊ���忼�����ܽ�ƽ��ԭ�������ʼ�ķ�Ӧ�����ӵ�֪ʶ�㣬���������Ǹ߿��������ͣ��ۺ��Խ�ǿ���漰֪ʶ��Ϲ㣬�ý̲Ļ���֪ʶ����֪ʶǨ�Ƶķ�����������ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ı��������� | B�� | �������Ƴɲ���� | ||
| C�� | �˵��в˺�ϴ���ͷŻص��� | D�� | ���ڵ��µĸֹ���п������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֱ���þƾ���Ƽ��� | B�� | KMnO4������ | ||
| C�� | ���ͷ��Ũ���� | D�� | KMnO4���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O2--DZˮͧ���������� | B�� | SiO2--�뵼����� | ||
| C�� | Al��OH��3--θ���кͼ� | D�� | Ca��ClO��2--������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƽ�����淴Ӧ�����ƶ� | B�� | a+b��c+d | ||
| C�� | Z������������� | D�� | X��ת�����½� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͭƬ������������Һ�У�Cu+Ag+�TCu2++Ag | |
| B�� | ��������������������Һ��Al+2OH-�TAlO2-+H2�� | |
| C�� | ̼�������ϡ�����У�CaCO3+2H+�TCa2++H2O+CO2�� | |
| D�� | ��м����ϡ�����У�2Fe+6H+�T2Fe3++3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0 | B�� | +2 | C�� | +3 | D�� | +6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com