
|
下列反应的离子反应方程式书写正确的是: | |
| [ ] | |
A. |
向碘化钾溶液中加入用硫酸酸化的过氧化氢溶液:2I-+H2O2=I2+2OH- |
B. |
向碳酸氢铵溶液中加入过量的稀氢氧化钠溶液: NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O |
C. |
向Ba(OH)2溶液中加入过量NH4HSO4: Ba2++H++NH4++2OH-+SO42-=BaSO4↓+H2O+NH3·H2O |
D. |
Fe2O3溶于过量的氢碘酸中:Fe2O3+6H+=2Fe3++3H2O |
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
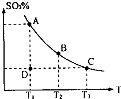 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:| Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(10分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ、测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 |
|
|
| 验证不稳定性 |
|
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市高三12月月考化学试卷 题型:填空题
(14分))某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。

已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
6.34 |
9.7 |
|
Fe3+ |
1.48 |
3.2 |
|
Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。
[Fe(OH)3的 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2010年湖南省高三上学期第三次月考化学试题 题型:实验题
(10分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ、测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。

(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
|
实 验 内 容 |
实 验 方 法 |
实 验 现 象 |
|
验证氧化性 |
|
|
|
验证不稳定性 |
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com