
| A. | 无色溶液中:Cl-,Na+,Fe3+,SO42- | |
| B. | 水电离的H+浓度c(H+)=10-12mol/L的溶液中:Cl-,CO32-,NH4+,S2O32- | |
| C. | 使pH=1溶液中:K+、Fe2+、NO3-、Cl- | |
| D. | 含有HCO3-的溶液中:NH4+、K+、Na+、SO32-、SO42- |
分析 A.Fe3+为黄色;
B.水电离的H+浓度c(H+)=10-12mol/L的溶液,为酸或碱溶液;
C.pH=1溶液,显酸性,离子之间发生氧化还原反应;
D.该组离子之间不反应.
解答 解:A.Fe3+为黄色,与无色不符,故A错误;
B.水电离的H+浓度c(H+)=10-12mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-、S2O32-,碱溶液中不能大量存在NH4+,故B错误;
C.pH=1溶液,显酸性,H+、Fe2+、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,Ca2+的配位数与F-的配位数之比为1:2 | |
| C. | 氢原子的电子云图如图3所示,表示一段时间内氢原子核外1个电子在空间出现的概率 | |
| D. | 金属Cu中铜原子堆积模型如图4,该金属晶体为面心立方最密堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | A | B | C | D | E | F |
| 烧瓶和气体的总质量(g) | 48.4082 | 48.4082 | 48.4082 | 48.3822 | 48.4342 | 48.8762 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 相同温度下,将足量氯化银固体分别加入:①蒸馏水、②0.1 mol•L-1氯化镁溶液、③0.1 mol•L-1盐酸、④0.1 mol•L-1硝酸银溶液中,充分溶解后Ag+浓度:①>③=④>② | |
| C. | 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后溶液的pH<7 | |
| D. | 为确定某酸H2A是强酸还是弱酸,可测定室温时NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
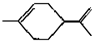 ,下列有关它的推测不正确的是( )
,下列有关它的推测不正确的是( )| A. | 它不能使酸性高锰酸钾溶液褪色 | |
| B. | 常温下为液态,易溶于水 | |
| C. | 分子式为C10H16 | |
| D. | 与过量的溴的CCl4溶液反应后产物为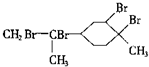 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com