
| A. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| B. | 在pH=12的溶液中:ClO-、SO32-、Na+、K+ | |
| C. | 能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO-、I- | |
| D. | 澄清透明的溶液中:Cu2+、Fe3+、NO3?、Cl ? |
分析 A.离子之间发生氧化还原反应;
B.pH=12的溶液,显碱性;
C.能与铝粉反应生成氢气的溶液,为非氧化性酸或强碱溶液;
D.该组离子之间不反应.
解答 解:A.Fe2+、NO3-、H+发生氧化还原反应,不能大量共存,故A错误;
B.pH=12的溶液,显碱性,ClO-、SO32-发生氧化还原反应,不能大量共存,故B错误;
C.能与铝粉反应生成氢气的溶液,为非氧化性酸或强碱溶液,酸性溶液中不能大量存在CH3COOO-,碱性溶液中不能大量存在Al3+,故C错误;
D.该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ①②③⑤⑥ | C. | ②③⑤⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能溶于水的盐是强电解质,不溶于水的盐是非电解质 | |
| B. | 强电解质溶液中不存在分子,弱电解质溶液中必存在溶质分子 | |
| C. | 在熔融状态下能导电的化合物一定是离子化合物,也一定是强电解质 | |
| D. | 强电解质一定能导电,非电解质的水溶液一定不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL 量筒量取5.25 mL盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH值为12.5 | |
| C. | 用托盘天平称取25.12g NaCl固体 | |
| D. | 配制70mL 0.1 mol/L的稀硫酸选用100 mL容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,由其结构可推知硼酸应属于弱酸(选填“弱”或“强”).
,由其结构可推知硼酸应属于弱酸(选填“弱”或“强”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的原子数为0.4NA | |
| B. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| C. | 含2mol H2SO4的浓硫酸与足量铜粉完全反应,生成气体分子的数目为2NA | |
| D. | 标准状况下,11.2L CCl4中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
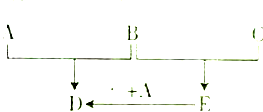 已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):
已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com