
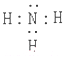 .
.分析 甲、乙两种氮的化合物中组成的元素种类和原子个数都相同.甲在受撞击下能发 生爆炸,8.6g 甲爆炸分解时生成 6.72L 氮气(标准状况下)和另一种气体,气物质的量n(N2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,结合元素守恒甲中除含氮元素外剩余质量=8,6g-0.3mol×28g/mol=0.2g,则另一种气体为H2,结合元素守恒计算得到甲的化学式,乙在标准状况下的密度为0.76g/L.摩尔质量=0.76g/L×22.4L/mol=17g/mol,所以乙为氨气,含氮化合物丙N4H4,易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一为甲,说明含铵根离子,则化学式为NH4N3,
解答 解:甲、乙两种氮的化合物中组成的元素种类和原子个数都相同.甲在受撞击下能发 生爆炸,8.6g 甲爆炸分解时生成 6.72L 氮气(标准状况下)和另一种气体,气物质的量n(N2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,结合元素守恒甲中除含氮元素外剩余质量=8,6g-0.3mol×28g/mol=0.2g,则另一种气体为H2,结合元素守恒计算得到甲的化学式,乙在标准状况下的密度为0.76g/L.摩尔质量=0.76g/L×22.4L/mol=17g/mol,所以乙为氨气,含氮化合物丙N4H4,易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一为甲,说明含铵根离子,则化学式为NH4N3,
(1)上述分析可知甲的化学式为HN3,乙的电子式为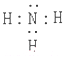 ,
,
故答案为:HN3;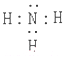 ;
;
(2)乙在高温下能还原Fe2O3,生成两种单质,为铁和氮气,结合原子守恒书写得到化学方程式为:2NH3+Fe2O3=N2+2Fe+3 H2O,
故答案为:2NH3+Fe2O3=N2+2Fe+3 H2O;
(3)丙化学式为NH4N3,和烧碱反应生成氨气、NaN3和水,反应的化学方程式为:NH4N3+NaOH=NaN3+NH3↑+H2O,
故答案为:NH4N3+NaOH=NaN3+NH3↑+H2O.
点评 本题考查了物质结构、性质和特征关系的计算分析判断,注意信息的理解应用,掌握基础是解题关键,题目难度中等.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 溶液中$\frac{c(O{H}^{-})}{c(HC{O}_{3}^{-})}$增大 |
| C | 50mL H2O | 由水电离出的c(H+)•c(OH-)不变 |
| D | 0.1mol NaHSO4固体 | 反应完全后,溶液pH减小,c (Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
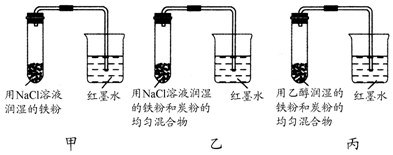
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023是阿伏加德罗常数的近似值 | |
| B. | 1 mol 12C的质量是12 g | |
| C. | 含有阿伏加德罗常数个粒子的物质就是1 mol | |
| D. | 1 mol O2含有6.02×1023个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3O3$\frac{\underline{\;放电\;}}{\;}$2O3 | B. | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | CO+CuO $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| D. | 液氨汽化时吸收大量的热,可用作制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com