
| 实 验 操 作 | 现 象 | 实 验 结 论 | |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO42- |
| B | 将某溶液蘸取少量放置于火焰上灼烧 | 火焰呈黄色 | 该溶液中一定含K+ |
| C | 往某溶液中加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
| D | 往某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向某溶液中加入硝酸酸化的氯化钡溶液,可能生成AgCl、BaSO4等沉淀;
B.根据钠离子、钠离子的焰色反应的火焰颜色判断;
C.三价铁离子遇到硫氰酸钾显示红色;
D.能和盐酸反应产生二氧化碳气体的离子可以是碳酸根离子还可以是碳酸氢根离子.
解答 解:A.向某溶液中加入硝酸酸化的氯化钡溶液,生成白色沉淀,不一定是SO42-,如果溶液中含有SO32-,能被氧化为SO42-,也不能排除生成AgCl沉淀,应先加盐酸酸化,如无沉淀,再加入氯化钡观察,故A错误;
B.将某溶液蘸取少量放置于火焰上灼烧,火焰呈黄色,说明溶液中一定含有Na+,故B错误;
C.因Fe3+与SCN-发生反应:Fe3++3SCN-=Fe(SCN)3,溶液呈血红色,所以溶液中滴入KSCN溶液后变红,说明该溶液中含有Fe3+,故C正确;
D.某溶液加入足量盐酸,放出的气体能使澄清石灰水变浑浊,该气体是二氧化碳或是二氧化硫,该溶液中含有CO32-、SO32-、HCO3-中的至少一种离子,故D错误;
故选C.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意检验离子的存在情况时,需要排除干扰离子,确保检验方案的严密性.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
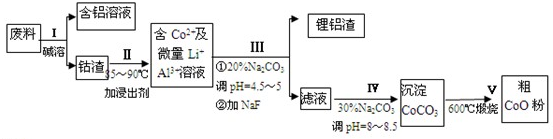
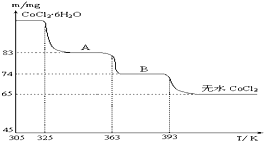
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
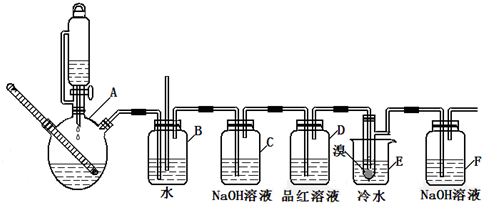
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com