
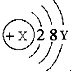 ,试回答:
,试回答:

科目:高中化学 来源: 题型:
| A、铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓外壳的腐蚀 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D、常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮藏贮运浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4、NH3、H2O、HF |
| B、HF、NH3、H2O、CH4 |
| C、H2O、HF、CH4、NH3 |
| D、HF、H2O、CH4、NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、5.4 kJ |
| B、350 kJ |
| C、3.5 kJ |
| D、8.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol碳正离子(CH3+)所含的电子总数为8 NA |
| B、1 mol甲基(-CH3)所含的电子总数为9NA |
| C、0.5mol 1,3-丁二烯分子中含有C=C双键数为 NA |
| D、标准状况下,22.4L庚烷完全燃烧所生成的气态产物的分子数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多 |
| B、第二周期元素从Li到F,非金属性逐渐减弱 |
| C、因为Na比K容易失去电子,所以Na比K的还原性强 |
| D、O与S为同主族元素,且O比S的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解AlCl3、FeCl3、CuCl2的混合溶液,阴极上依次析出Cu、Fe、Al |
| B、CO、NO、NO2、SO2都是大气污染气体,在空气中都能稳定存在 |
| C、在氨水中加入少量水,水的电离平衡向逆反应方向移动 |
| D、浓硫酸具有强氧化性,常温下能与铜发生剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com