
����Ŀ����֪������������ճ������м�Ϊ�������ᣬ��һ�������£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO+H+ ��H��0��
CH3COO+H+ ��H��0��
��1�����³�ѹ�£���pH=5��ϡ������Һ�У�c(CH3COO��=__������ȷֵ�����з����У�����ʹ0.10mol��L��1CH3COOH�ĵ���̶��������___��
a.��������0.10mol��L1��ϡ���� b.����CH3COOH��Һ c.�������������� d.��ˮϡ����0.010mol��L��1 e.���������Ȼ��ƹ��� f.��������0.10mol��L��1��NaOH��Һ
��2����֪��90��ʱ��ˮ�����ӻ�����ΪKw=38��10��14���ڴ��¶��£���pH=3�������pH=11������������Һ�������ϣ�������Һ�е�c(H+)=___��������λ��Ч���֣���
��3������Ũ�Ⱦ�Ϊ0.1mol/L��������Һ�������� �ڴ��� ���������� ���Ȼ�� �ݴ���� ������� ��������� �ఱˮ����ش��������⣺
��.�١��ڡ��ۡ���������Һ����ˮ�������H����Ũ���ɴ�С��˳����(�����)__��
��.�ܡ��ݡ��ޡ��ߡ���������Һ��NH4+Ũ���ɴ�С��˳����(�����)___��
��4��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣ���������£���a mol/L��CH3COOH��b mol/LBa��OH��2��Һ�������ϣ���Ӧƽ��ʱ��2c��Ba2+��=c��CH3COO-�����ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ___��
���𰸡���10��5��10��9��mol��L��1 bdf 2.05��10��11mol��L-1 �ܢڢۢ� �ޢߢܢݢ� ![]()
��������
��1����Һ��H�����������������Ļ���ˮ��������ġ�����ˮ�����ӻ���֪��ˮ���������c��H����=c��OH����=![]() =10��9mol��L��1����˴�����������c��H����=c��CH3COO����=��10��5��10��9��mol��L��1��������ڵĵ���ƽ��ΪCH3COOH
=10��9mol��L��1����˴�����������c��H����=c��CH3COO����=��10��5��10��9��mol��L��1��������ڵĵ���ƽ��ΪCH3COOH![]() CH3COO����H������
CH3COO����H������
a������������������Һc(H��)���Դ���ĵ������������ã�a����
b��������ʵĵ��������ȷ�Ӧ�������¶ȣ�����������뷽����У�b��ȷ��
c����������ᣬ����̶Ƚ��ͣ�c����
d����ˮϡ�ͣ�������Ũ�ȣ�������������ԭ����ƽ����Ũ������ķ�����У�������뷽����У�d��ȷ��
e�������Ȼ��ƹ��壬�Ե�����Ӱ�죬e����
f�������������ƣ�����H������ʹƽ������뷽����У�f��ȷ���ʴ�ѡbdf��
��2��pH=3��������c��H+��=10-3mol/L��pH=11������������Һ��c��OH-��=![]() =38��10-3mol/L����Ϻ�H++OH-=H2O�����Լ�ʣ�࣬ʣ�����������Ũ��Ϊc��OH-��=
=38��10-3mol/L����Ϻ�H++OH-=H2O�����Լ�ʣ�࣬ʣ�����������Ũ��Ϊc��OH-��=![]() =0.0185mol/L������c��H+��=
=0.0185mol/L������c��H+��=![]() ��2.05��10-11 mol��L-1��
��2.05��10-11 mol��L-1��
��3����.����ʹ��ᡢ�������ƾ�����ˮ�ĵ��룬��Ũ�ȵ�����ʹ��ᡢ������������Һ�е������H+��OH-Ũ�ȴ�С��ϵ��H2SO4��NaOH��CH3COOH����˶�ˮ�ĵ�����������ǿ����ϵΪ��H2SO4��NaOH��CH3COOH����ˮ���������H+Ũ�ȴ�С��ϵ��CH3COOH��NaOH��H2SO4������ΪNH4Cl�ܹ�ˮ�⣬��ˮ�ĵ�����ٽ����ã�����������Һ����ˮ�������H+Ũ���ɴ�С��˳��NH4Cl��CH3COOH��NaOH��H2SO4�����ܢڢۢ١�
��.�Ȼ�狀��������Һ�д�����NH4Cl=NH4++Cl-��NH4++H2O![]() NH3
NH3![]() H2O+H+���������Һ��CH3COONH4=CH3COO-+NH4+��CH3COO-+H2O
H2O+H+���������Һ��CH3COONH4=CH3COO-+NH4+��CH3COO-+H2O![]() CH3COOH+OH-��NH4++H2O
CH3COOH+OH-��NH4++H2O![]() NH3
NH3![]() H2O+H+�����������Һ��NH4HSO4=NH4++H++SO42-��NH4++H2O
H2O+H+�����������Һ��NH4HSO4=NH4++H++SO42-��NH4++H2O![]() NH3
NH3![]() H2O+H+����ˮ��NH3
H2O+H+����ˮ��NH3![]() H2O
H2O![]() NH4++OH-����Ũ�ȵ��������ʣ��������NH4+�ij�ʼŨ������Ȼ����Һ���������Һ�����������Һ��NH4+�ij�ʼŨ����ͬ���������CH3COO-ˮ�����ɵ�OH-��NH4+��ˮ����ٽ����ã����������H+��NH4+��ˮ�����������ã�������֮��NH4+Ũ�ȴ�СΪ��NH4HSO4��NH4Cl��CH3COONH4������Ϊ��ˮֻ�ܲ��ֵ��룬����������Һ�к��е�NH4+Ũ����С����������������Һ��NH4+Ũ���ɴ�С��˳���ǣ��ޢߢܢݢࣻ
NH4++OH-����Ũ�ȵ��������ʣ��������NH4+�ij�ʼŨ������Ȼ����Һ���������Һ�����������Һ��NH4+�ij�ʼŨ����ͬ���������CH3COO-ˮ�����ɵ�OH-��NH4+��ˮ����ٽ����ã����������H+��NH4+��ˮ�����������ã�������֮��NH4+Ũ�ȴ�СΪ��NH4HSO4��NH4Cl��CH3COONH4������Ϊ��ˮֻ�ܲ��ֵ��룬����������Һ�к��е�NH4+Ũ����С����������������Һ��NH4+Ũ���ɴ�С��˳���ǣ��ޢߢܢݢࣻ
��4�����������£���a mol/L��CH3COOH��b mol/L Ba(OH)2��Һ�������ϣ�������Һ���ֵ����ԣ�2c(Ba2��)+c(H+)��c(CH3COO��)+c(OH��)����2c(Ba2��)��c(CH3COO��)��b mol/L������Һ�������ԣ���c(H+)=c(OH��)=1��10-7mol/L�����ݴ���������������Һ��Ӧ�Ļ�ѧ����ʽȷ�����Һ��c(CH3COOH)=![]() mol/L���û����Һ�д���ĵ��볣��Ϊ
mol/L���û����Һ�д���ĵ��볣��Ϊ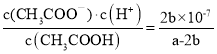 ��
��


 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij���淴Ӧm A(g)��n B(g) ![]() p C(g)���ܱ������н��У���ͼ��ʾ�ڲ�ͬ��Ӧʱ��tʱ���¶�T��ѹǿp�뷴Ӧ��B�ڻ�������е��������B%�Ĺ�ϵ���ߣ������߷����������ж���ȷ����(����)
p C(g)���ܱ������н��У���ͼ��ʾ�ڲ�ͬ��Ӧʱ��tʱ���¶�T��ѹǿp�뷴Ӧ��B�ڻ�������е��������B%�Ĺ�ϵ���ߣ������߷����������ж���ȷ����(����)

A.T1<T2��p1>p2��m��n>p�����ȷ�ӦB.T1>T2��p1<p2��m��n>p�����ȷ�Ӧ
C.T1<T2��p1>p2��m��n<p�����ȷ�ӦD.T1>T2��p1<p2��m��n<p�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ![]() ��Ϊ�о�Ӱ��÷�Ӧ���ʵ����أ��ڲ�ͬ�����½���4��ʵ�飬Y��Z����ʼŨ��Ϊ0����Ӧ��X��Ũ���淴Ӧʱ��ı仯�����ͼ��ʾ������˵������ȷ����( )
��Ϊ�о�Ӱ��÷�Ӧ���ʵ����أ��ڲ�ͬ�����½���4��ʵ�飬Y��Z����ʼŨ��Ϊ0����Ӧ��X��Ũ���淴Ӧʱ��ı仯�����ͼ��ʾ������˵������ȷ����( )
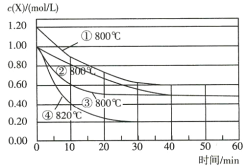
A.��ʵ��ڡ���ֻ�ı�һ������������ʵ��ڡ��ܵó����ۣ������¶ȣ���ѧ��Ӧ���ʼӿ�
B.��ʵ��١���ֻ�ı�һ������������ʵ��١��ڵó����ۣ�����Ӧ��Ũ�ȣ���ѧ��Ӧ���ʼӿ�
C.��ʵ��ڡ���ֻ�ı�һ����������ʵ���ʹ���˴���
D.0��10min�ڣ�ʵ��۵�ƽ������v(Y)=0.04 mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�![]() ��Ӧ��������ȷ��Ϊ
��Ӧ��������ȷ��Ϊ
A.��ԭ�������������ʵ���֮��Ϊ5:3
B.����lmolO2����Ӧ��ת��4mol����
C.����5molˮ����ԭ��ʱ����BrF3��ԭ��BrF3Ϊ![]() mol
mol
D.����5molˮ���뷴Ӧʱ����ˮ��ԭ��BrF3Ϊ2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ÿ�״̼�����ϡ���ᷴӦ��ȡ������̼���壬��ش�
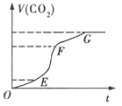
��1��ʵ�������ͼ��ʾ�������жϣ�������OE������EF������FG������ͬ��___�λ�ѧ��Ӧ�������___���ռ��Ķ�����̼������ࡣ
��2��ag��״̼������������ᷴӦ��̼������ĵ�������ʱ��ı仯������ʵ�߱�ʾ������ͬ�������£���bg(a>b)��ĩ״̼�������������ͬŨ�ȵ����ᷴӦ��̼������ĵ�������ʱ��ı仯���������߱�ʾ����ͼ�������ʵ�������ͼ����___������ţ���
A. B.
B.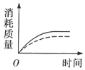 C.
C. D.
D.
��3��Ϊ�˼���������Ӧ�����ʣ����д�ʩ�У�����Ϊ���е���___������ţ�
A.��������ˮ
B.�����Ȼ��ƹ���
C.�����������Һ
D.����Ũ����
E.����
F.����MnO2��ĩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ĺ̶��Ǽ���������ѧ��һֱ�о��Ŀ��⡣
��1���±��о��˲�ͬ�¶��´����̵���ҵ�̵��IJ���Kֵ��
��Ӧ | �����̵� N2��g����O2��g�� | ��ҵ�̵� N2��g����3H2��g�� | |||
�¶�/�� | 27 | 2000 | 25 | 400 | 450 |
K | 3.8��10��31 | 0.1 | 5��108 | 0.507 | 0.152 |
���������ݿ�֪�������̵���Ӧ����_____��������������������������Ӧ��
���������ݿ�֪������ʺϴ��ģģ������̵���ԭ��__________________________��
��2����ҵ�̵���Ӧ�У�������������ͬʱ���ֱ�ⶨN2��ƽ��ת�����ڲ�ͬѹǿ��P1��P2�������¶ȱ仯�����ߣ���ͼ��ʾ��ͼʾ�У���ȷ����___������A������B�������Ƚ�P1��P2�Ĵ�С��ϵ��P1______P2(������������� ����)��
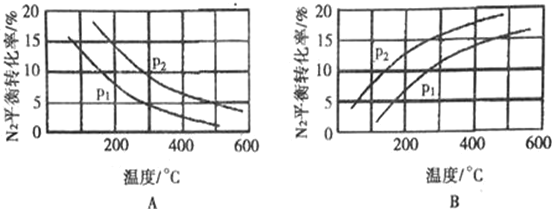
���� Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2��g��+3H2��g��![]() 2NH3��g��
2NH3��g��
��3����һ���¶��£���1mol N2��3mol H2����������������ܱ������з�����Ӧ���ﵽƽ��״̬ʱ��������������ʵ���Ϊ2.8mol����ƽ��ʱ��H2��ת������1��____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ϲ���Ὣ2019�궨Ϊ����ѧԪ�����ڱ�������������ʾ��Ԫ�������ɵ���Ҫ�ԡ��±��г���a~j10��Ԫ�������ڱ��е�λ�ã�
���� | IA | 0 | |||||||
1 | a | IIA | �� | IIIA | IVA | VA | VIA | VIIA | |
2 | b | �� | e | d | |||||
3 | c | f | �� | g | h | i | j |
(1)����Ԫ��b�ĵ�ز������������˽ܳ����ף�97��Ĺŵ��ɷ��ٻ�2019��ŵ������ѧ����bԭ�ӽṹʾ��ͼΪ____�������ع���ʱ����___��ת��Ϊ���ܡ�
(2)a~j10��Ԫ���У�������������K����������Ԫ����___��(������)����������ǿ��Ԫ����_____(дԪ�ط���)��
(3)Ԫ��g������������Ӧ��ˮ������NaOH��Һ��Ӧ�����ӷ���ʽΪ��_______��
(4)h��i��j����Ԫ�ص���̬�⻯���У����ȶ����⻯����______(д��ѧʽ)��
(5)Ԫ��i��һ�������ﳣ����Ư��ֽ������ñ��ȡ�����������л�ԭ�ԣ���һ�����������볣��������������Ӧ��д������һ����Ӧ�Ļ�ѧ����ʽ��_______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijͬѧ��Ƶ�ԭ���װ�ã�������������ȷ���ǣ� ��
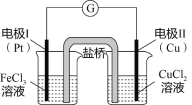
A.�缫���Ϸ�����ԭ��Ӧ����ԭ��صĸ���
B.������װ�к��Ȼ��ص���֬���������Ǵ��ݵ���
C.��ԭ��ص��ܷ�ӦΪ�� Fe3+��Cu=Cu2+��Fe2+
D.�缫��ĵ缫��ӦʽΪ��Cu��2e��=Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�����ݱ�����Ϣ����ش��������⣺
��ѧ��Ӧ | ƽ�ⳣ�� | �¶� | |
973K | 1173K | ||
��Fe(s)��CO2(g) | K1 | 1.47 | 2.15 |
��Fe(s)��H2O(g) | K2 | 2.38 | 1.67 |
��CO(g)��H2O(g) | K3 | �� | �� |
(1)��Ӧ����________(��������������������)��Ӧ��
(2)д����Ӧ�۵�ƽ�ⳣ��K3�ı���ʽ_______________________��
(3)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3��________(��K1��K2��ʾ)��
(4)Ҫʹ��Ӧ����һ�������½�����ƽ�����淴Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ��____(��д��ĸ���)��
A����С��Ӧ�������ݻ�B������Ӧ�������ݻ�
C�������¶�D��ʹ�ú��ʵĴ���
E���跨��Сƽ����ϵ�е�COŨ��
(5)����Ӧ�۵��淴Ӧ������ʱ��Ĺ�ϵ��ͼ��ʾ��
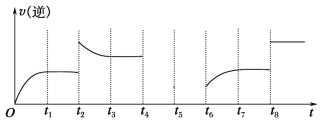
�ٿɼ���Ӧ��t1��t3��t7ʱ���ﵽ��ƽ�⣬��t2��t8ʱ���ı���һ�����������жϸı����ʲô������t2ʱ________��t8ʱ________��
����t4ʱ��ѹ��t6ʱ����Ӧ���Ũ�ȣ�����ͼ�л���t4��t6ʱ�淴Ӧ������ʱ��Ĺ�ϵ���ߡ�__________
����25����1.01��105Paʱ��16gҺ̬�״�(CH3OH)��ȫȼ�գ����ָ���ԭ״̬ʱ���ų�363.3kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ__________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com