
���������(Na2S2O3)�׳ƴ��մ�����ҵ��������Ӱ����Na2S2O3������ˮ����������Һ�����ᷴӦ�е������SO2���ɡ�
��1��Na2S2O3��Һ��ϡ�����Ϸ�Ӧ������̽����������Է�Ӧ���ʵ�Ӱ�죬����йص�ʵ����Ʊ�(��֪����Һ�����Ϊ5 mL)��
| ʵ���� | T/K | c(Na2S2O3)/ mol��L��1 | c(H2SO4)/ mol��L��1 | ʵ��Ŀ�� |
| �� | 298 | 0.1 | 0.1 | ʵ��ٺ͢�̽���¶ȶԸ÷�Ӧ���ʵ�Ӱ�죻ʵ��١��ۺ͢�̽����Ӧ��Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ�� |
| �� | 308 | | | |
| �� | | 0.2 | | |
| �� | | 0.1 | |
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1��ȡ�����������Թ��У�������ˮ�ܽ� | |
| ����2�� | |
| ����3�� | |
��16�֣�
(1) ������ÿ��1�֣���6��ʵ���� T/K c(Na2S2O3)/mol��L��1 c(H2SO4)/mol��L��1 �� �� 0.1 0.1 �� 298 0.1 �� 298 0.2(����0.1�ľ�����)
��2��Na2S2O3+4Cl2+5H2O =Na2SO4+8HCl+H2SO4(2�֣�δ��ƽ��1��)
����Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4)
��3��ʵ�鲽�� Ԥ������ͽ��� ����1��ȡ�����������Թ��У�������ˮ�ܽ� ����2�����Թ��м������1 mol��L��1 HCl��Һ�����������(2��) �е���ɫ��������(2��) ����3��ȡ�ϲ���Һ����һ�Թ��У��μ�����0.1 mol��L��1BaCl2��Һ(2��) �а�ɫ�������ɣ�֤�������л���Na2SO4(2��)
[���ް�ɫ�������ɣ�֤����������Na2SO4]
����2�������������۲�������δд����������1�֣�ȱ�١��������һ�֡�����ͽ����У��̼�����ζ��������ݲ����ɸ��֡�
����3���ޡ����������۷֣���BaCl2д��Ba(NO3)2�IJ��÷֣�����������ͽ���
���������������1����ƶԱ�ʵ��ʱ�����������������ֲ��䣬ֻ��һ���������������֪������ڵ�Ŀ����̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ����ɣ�������ַ�Ӧ�����ʼŨ��Ӧ���ֲ��䣬����0.1mol/L������۵�Ŀ����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ����ɣ����¶ȶ���298K������ij�ʼŨ�ȶ���0.1mol/L������ܵ�Ŀ����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ����ɣ����¶ȶ���298K����������Ƶij�ʼŨ�ȶ���0.1mol/L������ij�ʼŨ�ȱ�Ϊ0.2mol/L�����������Ĵ𰸣���2����дİ����������ԭ��Ӧʱ����ȷ������������ԭ������������ͻ�ԭ�����ȷ�����ϼ�������Ŀ��Ȼ�������С��������ȷ���������ͻ�ԭ����ϵ��������ù۲취��ƽ�������ʵ�ϵ���������������÷�ӦΪNa2S2O3+4Cl2+5H2O === Na2SO4+8HCl+H2SO4��Na2S2O3+4Cl2+5H2O === 2NaCl+6HCl+2H2SO4����3�������Ƴ�����������ӵij��������飬����Na2S2O3Ҳ�����Ȼ�����Һ������ɫ���������������Ƶļ��飬������Ҫ�ȳ�ȥ��Ʒ�е�Na2S2O3������Na2S2O3������ˮ����������Һ�����ᷴӦ�е������SO2���ɣ��������������������ӣ������ܽ�����������������Ϊ��������ӣ�������������ӵļ��飬��˲���2��ֻ�ܼ������1 mol��L��1 HCl��Һ����������ã��е���ɫ�������ɻ�����д̼�����ζ�����壬˵��Na2S2O3�Ѿ���ת��ΪNaCl���������SO2����ȥ������������֮��ȡ�ϲ���Һ����һ�Թ��У��μ�����0.1 mol��L��1BaCl2��Һ�����а�ɫ�������ɣ�֤�������л���Na2SO4[���ް�ɫ�������ɣ�֤����������Na2SO4]��
���㣺����̽��ʵ�飬�漰���ʵ�鷽��̽����������Ի�ѧ��Ӧ���ʵ�Ӱ�졢������ԭ��Ӧ����ʽ����д����ƽ�����ʵ�鷽�����������ƵĴ��ڡ����ʵ�鷽����ȥ�������е���������Ƶȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
���ܱ������У���1.0molCO��1.0molH2O��ϼ��ȵ�800�棬�������з�Ӧ��
CO(g)+H2O(g) CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
(1)�ﵽƽ��ʱCO2�����ʵ��������÷�Ӧ�Ļ�ѧƽ�ⳣ����
(2)�ﵽƽ������ƽ����ϵ��ͨ��1.0molˮ�������ﵽ�µ�ƽ��״̬ʱ����ˮ���������ʵ�����CO2�����ʵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������H2O2�ڷ�Ӧʱ��������Ⱦ�����Ϊ��ɫ������������ܵ�����Խ��Խ��Ĺ�ע��
��.ijʵ��С����H2O2�ֽ�Ϊ����̽��Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�졣�ڳ����°����±���ʾ�ķ������ʵ�顣
| ʵ���� | ��Ӧ�� | ���� |
| �� | 10 mL 2%H2O2��Һ | �� |
| �� | 10 mL 5%H2O2��Һ | �� |
| �� | 10 mL 5%H2O2��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |
| �� | 10 mL 5%H2O2��Һ������HCl��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |
| �� | 10 mL 5%H2O2��Һ������NaOH��Һ | 1 mL 0.1 mol��L��1FeCl3��Һ |



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
ijѧ��Ϊ��̽��п�����ᷴӦ���������ʱ仯����100mLϡ�����м���������п�ۣ���״���²�������ۼ�ֵ���£�
| ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
| ���������mL�� | 50 | 120 | 232 | 290 | 310 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
������ij�о�С���о��Ĺ��ڲ�ͬ������H2O2�ֽⷴӦ�Ĵ�Ч�ʡ�
| ����(0.1g) | ����̿ | FeCl3 | KI | MnO2����״ | MnO2��ĩ״ |
| ǰ15s������������(ml) | 5 | 11 | 7 | 8 | 11 |
| ǰ30s������������(ml) | 8 | 16 | 11 | 11 | 21 |
| ǰ45s������������(ml) | 11 | 20 | 15 | 18 | 35 |
| ǰ60s������������(ml) | 15 | 24 | 20 | 26 | 49 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�ס�������ʵ��С��ֱ�����KMnO4������Һ��H2C2O4��Һ��Ӧ�����о�������ضԷ�Ӧ���ʵ�Ӱ�졣���ʵ�鷽�����£�
���飺ͨ���ⶨ����CO2��������ķ������Ƚϻ�ѧ��Ӧ���ʵĴ�С��
ʵ��װ����ͼ��ʵ��ʱ��Һ©����A��Һһ���Է���B��Һ��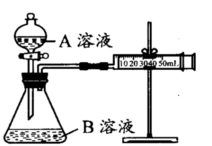
(ע��ʵ��������KMnO4��Һ���Ѽ�����ͬ��H2SO4)��
| ��� | A��Һ | B��Һ |
| �� | 2 mL 0.1mol/LH2C2O4��Һ | 4 mL0.01mol/LKMnO4��Һ |
| �� | 2 mL 0.2mol/LH2C2O4��Һ | 4 mL0.01mol/LKMnO4��Һ |
| ʱ�䣨min�� | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| ��(KMnO4) (10-4mol/(L��min) | �� | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
| ʵ�鲽�輰���ۣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�pH = 12��NaOH��Һ��pH =1��HC1��Һ��һ��������ϣ�������ҺpH =2����NaOH��Һ��HC1��Һ�������Ϊ
| A��9��2������ | B��2��9������ | C��1��9������ | D��10��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£���֪0.1mol��L-1��CH3COOH��HCN��Һ��PH�ֱ�Ϊa��b����1<a< b�������й���������ȷ���ǣ� ��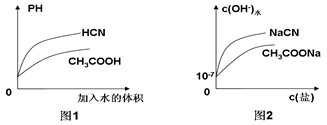
| A�������£���Ũ�ȵ�CH3COONa��Һ��NaCN��Һ��PHǰ�߽�С |
| B����NaCN��Һ�У�c (Na+��+ c (H+) ��c (OH-��+ c (CN-) |
| C����ͬ�¶��£���ͬPH��CH3COOH��HCN��Һ�ֱ��ˮϡ�ͣ���ҺPH����Һ����仯��������ͼ1��ʾ |
| D�������£�CH3COONa��Һ��NaCN��Һ����ˮ�������c(OH-)����Ũ�ȵı仯������ͼ2��ʾ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
A����25�洿ˮ������95��ʱ,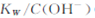 ���� ���� |
B����pH=11��Na2CO3��Һ��ˮϡ��, ���� ���� |
| C��������,pH=a��������pH=b�İ�ˮ�������Ϻ�pH=7,��a+b="14" |
| D��0��1mol��L-��HA��0��1mol��L-NaOH��Һ�������Ϻ�pH>7,�� |
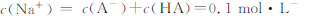
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com