
分析 铜、锌、稀硫酸构成的原电池中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,据此分析解答.
解答 解:(1)铜、锌、稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,负极上电极反应式为 Zn-2e-=Zn2+,锌片逐渐溶解;故答案为:锌、Zn-2e-=Zn2+、氧化、锌片逐渐溶解;
(2)铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,铜电极上有氢气生成,所以看到的现象是铜片上有气泡产生,故答案为:2H++2e-=H2↑、铜片表面产生气泡;
(3)负极上电极反应式为 Zn-2e-=Zn2+,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,所以总反应Zn+2H+=Zn2++H2↑,消耗氢离子,则溶液PH值增大,故答案为:Zn+2H+=Zn2++H2↑、增大;
(4)电子从负极锌沿导线流向正极铜,故答案为:锌、铜.
点评 本题考查了原电池原理,明确正负极上得失电子、反应类型、电极反应式的书写即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 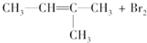 → → | |
| B. | CH2═CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH═CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | nCH2═CH2+nCH2═CH-CH3$→_{△}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 4.6 g Na与稀盐酸反应,转移电子数一定为0.2NA | |
| C. | 10.6 g Na2C03晶体中含CO${\;}_{3}^{2-}$数目为0.1NA | |
| D. | 常温下,22g CO2含碳氧双键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素全部是副族元素 | |
| B. | 周期表中的周期分为:短周期、长周期 | |
| C. | 周期表中的族分为:主族、副族、0族和VIII族 | |
| D. | 由短周期元素和长周期元素共同组成的族称为主族(除0族外) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
| B. | CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 | |
| C. | 当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 | |
| D. | 已知苹果酸的结构简式为 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com