
【题目】铝是一种轻金属,被称为金属界的“万金油”,应用范围极为广阔。含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。
完成下列填空:
(1)铝是活泼金属,在干燥空气中铝的表面立即形成厚约5 nm的致密氧化膜,写出除去氧化膜的一种方法____________________(用方程式表示)。
(2)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因_____________________(用方程式说明);写出Al(OH)3的电离方程式________________。
(3)明矾(KAl(SO4)2·12H2O)的水溶液呈_______性(选填“酸”、“碱”或“中”),溶液中离子浓度大小顺序为_____________________。将明矾溶液与小苏打溶液混合会产生白色沉淀和气体,请用平衡移动原理解释该现象。_______________________________________
(4)碳热还原氯化法从铝土矿中炼铝具有步骤简单、原料利用率高等优点,其原理如下:
Ⅰ. Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) – 1486 kJ
3AlCl(g) + 3CO(g) – 1486 kJ
Ⅱ. 3AlCl(g) ![]() 2Al(l) + AlCl3(g) + 140 kJ
2Al(l) + AlCl3(g) + 140 kJ
① 写出反应Ⅰ的化学平衡常数表达式K=_____________,升高温度,K_______(填增大、减小、不变)。
② 写出反应Ⅱ达到平衡状态的一个标志_________________________________;
结合反应Ⅰ、Ⅱ进行分析,AlCl3在炼铝过程中的作用可以看作______________。
③ 将1mol氧化铝与3mol焦炭的混合物加入2L反应容器中,加入2mol AlCl3气体,在高温下发生反应Ⅰ。若5min后气体总质量增加了27.6g,则AlCl的化学反应速率为_________ mol/(L·min)。
【答案】Al2O3 + 6HCl =2AlCl3 + 3H2O或Al2O3 + 2NaOH=2NaAlO2 + H2O 2Al(OH)3![]() Al2O3 + 3H2O Al3+ + 3OH-
Al2O3 + 3H2O Al3+ + 3OH-![]() Al(OH)3
Al(OH)3![]() H++AlO2- + H2O 酸 c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-) 铝离子水解呈酸性,Al3+ + H2O
H++AlO2- + H2O 酸 c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-) 铝离子水解呈酸性,Al3+ + H2O![]() Al(OH)3+3H+,碳酸氢根水解呈碱性HCO3- + H2O
Al(OH)3+3H+,碳酸氢根水解呈碱性HCO3- + H2O![]() H2CO3 + OH-,两者水解相互促进,平衡向右进行,因此出现沉淀与气体
H2CO3 + OH-,两者水解相互促进,平衡向右进行,因此出现沉淀与气体 ![]() 增大 压强不变(合理即可) 催化剂 0.06
增大 压强不变(合理即可) 催化剂 0.06
【解析】
(1)氧化铝属于两性氧化物,可以与盐酸,也可以与氢氧化钠反应;
(2) 氢氧化铝分解吸热,生成的氧化铝覆盖在可燃物表面,起到阻燃作用;氢氧化铝是两性氢氧化物;
(3)明矾电离出的铝离子能够水解呈酸性,碳酸氢根水解呈碱性,两者水解相互促进;
(4) ① 根据化学平衡常数表达式书写K的表达式;该反应为吸热反应,结合平衡移动的影响因素分析判断;
②根据平衡状态的特征和标志分析解答;将反应Ⅰ+反应Ⅱ得:Al2O3(s) + 3C(s) ![]() 3CO(g) +2Al(l),据此分析判断AlCl3的作用;
3CO(g) +2Al(l),据此分析判断AlCl3的作用;
③Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) 属于气体质量的增加的反应,结合气体总质量的增加量计算出AlCl的物质的量,再结合化学反应速率=
3AlCl(g) + 3CO(g) 属于气体质量的增加的反应,结合气体总质量的增加量计算出AlCl的物质的量,再结合化学反应速率=![]() 计算。
计算。
(1)氧化铝属于两性氧化物,可以用盐酸,也可以用氢氧化钠除去铝片表面的氧化膜,反应方程式为Al2O3 + 6HCl =2AlCl3 + 3H2O或Al2O3 + 2NaOH=2NaAlO2 + H2O,故答案为:Al2O3 + 6HCl =2AlCl3 + 3H2O或Al2O3 + 2NaOH=2NaAlO2 + H2O;
(2) 氢氧化铝受热分解吸热,同时生成的氧化铝熔点高,覆盖在可燃物表面,起到阻燃作用,氢氧化铝分解的方程式为2Al(OH)3![]() Al2O3 + 3H2O,氢氧化铝是两性氢氧化物,电离方程式为Al3+ + 3OH-
Al2O3 + 3H2O,氢氧化铝是两性氢氧化物,电离方程式为Al3+ + 3OH-![]() Al(OH)3
Al(OH)3![]() H++AlO2- + H2O,故答案为:2Al(OH)3
H++AlO2- + H2O,故答案为:2Al(OH)3![]() Al2O3 + 3H2O;Al3+ + 3OH-
Al2O3 + 3H2O;Al3+ + 3OH-![]() Al(OH)3
Al(OH)3![]() H++AlO2- + H2O;
H++AlO2- + H2O;
(3)明矾(KAl(SO4)2·12H2O)属于强酸弱碱盐,铝离子水解,溶液呈酸性,溶液中离子浓度大小顺序为c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-)。将明矾溶液与小苏打溶液混合会产生白色沉淀和气体,是因为铝离子水解呈酸性,Al3+ + H2O![]() Al(OH)3+3H+,碳酸氢根水解呈碱性HCO3- + H2O
Al(OH)3+3H+,碳酸氢根水解呈碱性HCO3- + H2O![]() H2CO3 + OH-,两者水解相互促进,平衡向右进行,因此出现沉淀与气体,故答案为:酸;c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);铝离子水解呈酸性,Al3+ + H2O
H2CO3 + OH-,两者水解相互促进,平衡向右进行,因此出现沉淀与气体,故答案为:酸;c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);铝离子水解呈酸性,Al3+ + H2O![]() Al(OH)3+3H+,碳酸氢根水解呈碱性HCO3- + H2O
Al(OH)3+3H+,碳酸氢根水解呈碱性HCO3- + H2O![]() H2CO3 + OH-,两者水解相互促进,平衡向右进行,因此出现沉淀与气体;
H2CO3 + OH-,两者水解相互促进,平衡向右进行,因此出现沉淀与气体;
(4) ① 反应Ⅰ.Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) – 1486 kJ的化学平衡常数表达式K=
3AlCl(g) + 3CO(g) – 1486 kJ的化学平衡常数表达式K=![]() ,该反应为吸热反应,升高温度,平衡正向移动,K增大,故答案为:
,该反应为吸热反应,升高温度,平衡正向移动,K增大,故答案为:![]() ;增大;
;增大;
② 反应Ⅱ达到平衡状态时,各种气体的物质的量浓度不变,气体的压强不变等;反应Ⅰ+反应Ⅱ得:Al2O3(s) + 3C(s) ![]() 3CO(g) +2Al(l)– 1346 kJ,说明AlCl3在炼铝过程中是催化剂,故答案为:压强不变(合理答案均可);催化剂;
3CO(g) +2Al(l)– 1346 kJ,说明AlCl3在炼铝过程中是催化剂,故答案为:压强不变(合理答案均可);催化剂;
③设生成的AlCl的物质的量为x,
Al2O3(s) + AlCl3(g) + 3C(s) ![]() 3AlCl(g) + 3CO(g) 气体质量的增加量
3AlCl(g) + 3CO(g) 气体质量的增加量
3mol 138g
X 27.6g
则![]() =
=![]() ,解得:x=0.6mol,则AlCl的化学反应速率=
,解得:x=0.6mol,则AlCl的化学反应速率=![]() =0.06mol/(L·min),故答案为:0.06。
=0.06mol/(L·min),故答案为:0.06。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________。
(2)已知在25℃、101kPa下,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧热的热化学方程式_______________。
(3)标准状况下,4.48L H2在足量O2中完全燃烧放出热量Q kJ,写出H2燃烧的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
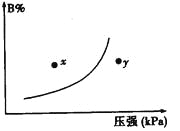
①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A. ①②⑤ B. 只有②④ C. 只有①③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的镁条,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(1)D溶液为_______________;同浓度的四种溶液中,pH值最大的是______________(填化学式)溶液。
(2)pH值和体积均相同的A和C溶液,分别与足量大小完全相同的锌粒反应,开始时的反应速率
v(A)______________v(C) (填“>”“<”或“=”)
(3)等体积等浓度的氨水和盐酸混合后,所得溶液呈______________(填“酸性”、“碱性”或“中性”),用离子方程式解释其原因__________________________________。
(4)常温下,2mol/L的NaOH溶液与amol/L的醋酸溶液等体积混合后,发现溶液呈中性,
试计算:该温度下醋酸钠的水解平衡常数Kb=________________(用含a的代数式表示。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A的一价阴离子的电子层结构与氩原子相同,元素B的二价阳离子的电子层结构与氖原子相同。请回答:
(1)元素A离子的结构示意图为___,A的单质呈___色,检验该物质的方法是___。
(2)由A、B形成的化合物的电子式是___。
(3)与A离子具有相同电子数的一种分子是___(填名称)。
(4)A的单质与Ca(OH)2反应的化学方程式___,该反应工业上的用途是___。
(5)蓝色石蕊试纸遇到A的水溶液现象是___,请你解释这个现象___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
A.ν(H2O)=0.6 mol/(L·s)B.ν(O2)=0.72 mol/(L·s)
C.ν(NO)==0.9 mol/(L·s)D.ν(NH3)=0.4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g)达到平衡时的标志是( )
2HI(g)达到平衡时的标志是( )
A.混合气体密度恒定不变B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等D.I2在混合气体中体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是( )
A. 0.1mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H+)
B. 若将CO2通入0.1mol/LNa2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是中学化学中一种重要的物质。请回答下列问题:
Ⅰ.一定条件下,烧杯中H2O2溶液发生分解反应放出气体的体积和时间的关系如图所示:
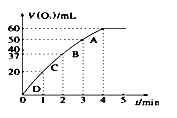
则由D到A过程中,随着反应的进行反应速率逐渐_________(选填 “加快”或“减慢”),其变化的原因是________________________________________。
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。
(1)定性图甲可通过观察_________定性比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液更合理,其理由是_______。
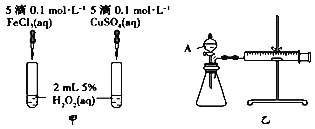
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为_______,实验中需要测量的数据是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com