
| A、NaCl溶液在电流的作用下电离出Na+ |
| B、离子化合物一定是电解质 |
| C、氨水呈弱碱性,故NH3是弱电解质 |
| D、溶于水电离出氢离子的化合物都是酸 |


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
| A、28g乙烯所含共用电子对数目为4NA |
| B、0.5 mol1,3-丁二烯分子中含有C=C双键数为 NA |
| C、1 mol羟基所含的电子总数为9NA |
| D、标准状况下,11.2 L己烷所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01 mol?L-1的蔗糖溶液 |
| B、0.01 mol?L-1的CaCl2溶液 |
| C、0.02 mol?L-1的NaCl溶液 |
| D、0.02 mol?L-1的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
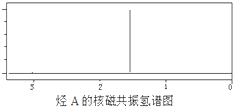 某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:
某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:| ①O3 |
| ②H2O |
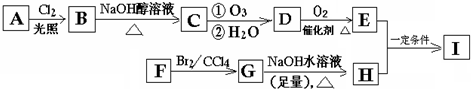
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl-、Fe3+、NO3-、OH- |
| B、HCO3-、Cl-、Na+、H+ |
| C、Ba2+、Cl-、NO3-、K+ |
| D、NH4+、K+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:3 |
| C、3:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com