
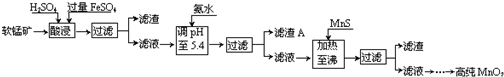
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
分析 软锰矿的主要成分为MnO2,还含有Si、Fe、Al、Zn和Cu等元素的化合物,硫酸亚铁在酸性条件下将MnO2还原为MnSO4,所以酸浸后的滤液中的金属阳离子主要是Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+等,由离子开始沉淀及沉淀完全的pH可知,调节pH为5.4,将Fe3+、Al3+沉淀,加入硫化锰将Cu2+、Zn2+沉淀,滤液为硫酸锰溶液,再通过系列变化得到高纯度的二氧化锰,
(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,则Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成;
(2)调节溶液的pH值要用到pH计或精密pH试纸进行测量,由题目信息可知,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH进行判断;
(3)由碱性锌锰干电池的电池反应式可知,Zn作负极,MnO2得电子作正极,生成MnOOH,由电荷守恒可知还生成OH-,由元素守恒可知,还有水参与反应;
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应锰离子失电子生成二氧化锰;
(5)根据K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{Ksp(Fe(OH)_{3})}{Kw}$计算.
解答 解:(1)根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,故酸浸时生成硫酸锰、硫酸铁,根据元素守恒还有水生成,反应方程式为2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O,
故答案为:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O;
(2)调节溶液的pH值要用到pH计或精密pH试纸进行测量,酸浸后的过滤液中含有Mn2+、Fe3+、Al3+、Cu2+、Zn2+、Fe2+,加氨水调pH至5.4,结合题中阳离子以氢氧化物形式完全沉淀时溶液的pH可知,Fe3+、Al3+完全转化为Fe(OH)3和Al(OH)3沉淀,其它离子不沉淀,故滤渣A的主要成分为
Fe(OH)3和Al(OH)3,
故答案为:pH计或精密pH试纸;Fe(OH)3和Al(OH)3;
(3)碱性锌锰干电池中Zn作负极,则MnO2作正极得电子,其电极反应式应为MnO2+H2O+e-=MnOOH+OH-,
故答案为:MnO2+H2O+e-=MnOOH+OH-;
(4)MnO2可作超级电容器材料.用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是Mn2++2H2O-2e-═MnO2+4H+,
故答案为:Mn2++2H2O-2e-═MnO2+4H+;
(5)由离子方程式可知,K=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$=$\frac{c(F{e}^{3+})}{{c}^{3}({H}^{+})}$×$\frac{{c}^{3}(O{H}^{-})}{{c}^{3}(O{H}^{-})}$=$\frac{Ksp(Fe(OH)_{3})}{Kw}$=$\frac{2.79×1{0}^{-39}}{(1×1{0}^{-14})^{3}}$=2.79×103,
故答案为:2.79×103.
点评 本题考查学生对元素及其化合物的主要性质的掌握、书写电极反应方程式、阅读题目获取新信息能力、对工艺流程的理解等,难度中等,需要学生具备扎实的基础与综合运用知识、信息分析解决问题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
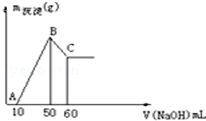 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol•L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示,回答下列问题,要求写出计算过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,用湿润的红色石蕊试纸在试管口观察现象 | |
| B. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| C. | 加强碱溶液,加热,滴入酚酞试液,观察溶液颜色 | |
| D. | 加苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 用惰性电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | H218O中投入Na2O2固体:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | FeBr2溶液中通入足量的氯气:2Fe2++2Br-+2C12=2Fe3++Br2+4C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
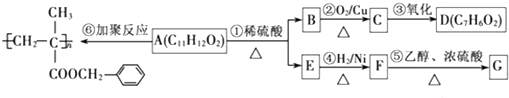
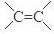 、-COOH;F的名称2-甲基丙酸(系统命名法命名).
、-COOH;F的名称2-甲基丙酸(系统命名法命名).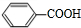 .
.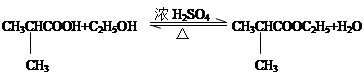 .⑤的反应类型是酯化反应(或取代反应).
.⑤的反应类型是酯化反应(或取代反应).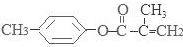 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v1增大,v2减小 | B. | v1减小,v2增大 | C. | 同时增大 | D. | 同时减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com