
| A.b≥40y(2-) | B.b≥8 0y(2-) 0y(2-) |
| C.b≥40y(1-) | D.b≥80y(1-) |
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 __________________________________现象,可证明磁铁矿石中存在+2价铁元素。
__________________________________现象,可证明磁铁矿石中存在+2价铁元素。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、
下列流程图,完成回收硫酸亚铁和铜的实验方案。(可供选择的试剂为铁粉、稀H2SO4、 NaOH溶液等试剂)
NaOH溶液等试剂)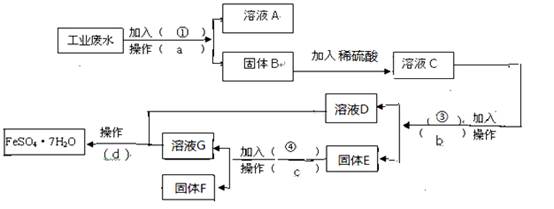 (1)操作a的名称为 ,所需要的玻璃仪器为 ____。
(1)操作a的名称为 ,所需要的玻璃仪器为 ____。 ____,加入的试剂④为 __,发生的化学方程式为 。
____,加入的试剂④为 __,发生的化学方程式为 。  的是 ____________。
的是 ____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2O | B.NO | C.N2O3 | D.NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
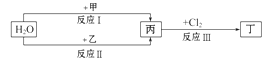
| A.工业上生产甲可以用热还原法 |
| B.反应Ⅱ的另外一种产物具有磁性 |
| C.向乙与Cl2反应产物的溶液中滴加KSCN溶液,无明显现象 |
| D.当有1mol乙参加反应Ⅱ时转移8mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 8Na2CrO4 + 2Fe2O3 + 8CO2
8Na2CrO4 + 2Fe2O3 + 8CO2 2NaAlO2 + CO2↑等
2NaAlO2 + CO2↑等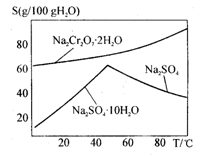
 是______(填序号)。
是______(填序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 。用此溶液进行以下实验:
。用此溶液进行以下实验: 应的化学方程式:
应的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com