

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
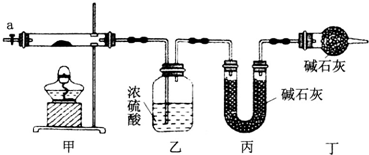
分析 (1)按如图所示装置组装好仪器,应首先检验装置的气密性,加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,步骤中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果;
(2)空气中的水蒸气和二氧化碳被乙丙装置吸收产生误差,在活塞a前,加装装置干燥管,装置中盛放的碱石灰用来吸收空气中的水蒸气和二氧化碳;
(3)碱式碳酸钴样品3.65g,故生成水的质量为0.36g,物质的量为 $\frac{0.36g}{18g/mol}$=0.02mol,生成二氧化碳的质量为0.88g,物质的量为 $\frac{0.88g}{44g/mol}$=0.02mol,故氧化钴的质量为3.65g-0.36g-0.88g=2.41g,物质的量为 $\frac{2.41g}{75g/mol}$=0.03mol,根据Co、H、C元素守恒计算xyz的比值得到化学式;
(4)含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O,加入过量盐酸酸浸加热,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钙调节溶液PH使铁离子、铝离子全部沉淀,过滤得到滤液中加入盐酸防止氯化钴水解,通过蒸发浓缩,冷却结晶过滤洗涤干燥等操作得到CoCl2•6H2O;
①三价铁离子易转化为沉淀,所以要把二价铁离子氧化为三价铁离子;
②调节溶液的pH值,使溶液中铁离子和铝离子生成沉淀,而钴离子存在溶液中,从而将铁离子、铝离子和钴离子分开;
③加盐酸调整pH为2~3的目的是抑制氯化钴的水解.
解答 解:(1)按如图所示装置组装好仪器,应首先检验装置的气密性,加热甲中玻璃管,当乙装置中不再有气泡产生,即碱式碳酸钴分解完毕,步骤中缓缓通入空气数分钟,将装置中生成的CO2和H2O全部排入乙、丙装置中,以免影响测量结果,
故答案为:检验装置的气密性,不再有气泡产生,将装置中生成的CO2和H2O全部排入乙、丙装置中;
(2)空气中的水蒸气和二氧化碳被乙丙装置吸收产生误差,在活塞a前,加装装置干燥管,装置中盛放的碱石灰用来吸收空气中的水蒸气和二氧化碳;
故答案为:未考虑空气中的水蒸气和二氧化碳对实验的影响;
(3)碱式碳酸钴样品3.65g,故生成水的质量为0.36g,物质的量为 $\frac{0.36g}{18g/mol}$=0.02mol,生成二氧化碳的质量为0.88g,物质的量为 $\frac{0.88g}{44g/mol}$=0.02mol,故氧化钴的质量为3.65g-0.36g-0.88g=2.41g,物质的量为 $\frac{2.41g}{75g/mol}$=0.03mol,根据Co、H、C元素守恒可知,x:y:z=0.03mol:0.02mol×2:0.02mol=3:4:2,故碱式碳酸钴的化学式为Co3(OH)4(CO3)2,故答案为:Co3(OH)4(CO3)2;
(4)①三价铁离子易转化为沉淀,所以要加入氧化剂过氧化氢把二价铁离子氧化为三价铁离子,而不会引入新的杂质,反应的离子方程式为;2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②废料加入盐酸后生成氯化物,然后加入双氧水,二价铁离子被双氧水氧化生成三价铁离子,根据沉淀的pH值表格知,当溶液的pH值为5.2时,铁离子和铝离子被完全沉淀,当溶液的pH值为7.6时,钴离子才开始产生沉淀,所以要想将铁离子、铝离子和钴离子分离,溶液的pH值应该不小于5.2不大于7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
故答案为:Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解,故答案为:抑制CoCl2的水解.
点评 本题考查学生对实验原理理解、方案设计的评价、实验装置的理解、物质组成的测定等,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具有扎实的基础与综合运用分析解决问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 铝合金熔点低,可用来制造门窗 | |
| B. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| C. | 过氧化钠固体呈淡黄色,可用来做供氧剂 | |
| D. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的CH3COOH溶液加水稀释10倍,溶液中各离子浓度均减小 | |
| B. | 用CH3COOH溶液滴定等浓度的NaOH至pH=7,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2moj/L的盐酸中加入等体积0.1mol/L氨水溶液:c(Cl-)+c(OH-)=c(H+)+c(NH3••H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对应简单离子半径的大小顺序为:D>B>A | |
| B. | C的最高价氧化物对应水化物的酸性比D的强 | |
| C. | A分别与B、C形成的化合物中化学键类型相同 | |
| D. | B、C单质均能和氢氧化钠溶液发生反应生成氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
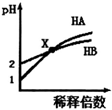
| A. | HB一定是弱酸 | |
| B. | 在x点,c(A-)=c(B-) | |
| C. | 稀释前由水电离出的c(H+),HB溶液是HA溶液的10倍 | |
| D. | 取x点时的两种酸溶液,分别中和等体积等浓度的NaOH溶液,消耗HA溶液的体积一定小于HB溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 共价键 | f-f | g-g | h-h | i-i |
| 键能(kJ/mol) | 157 | 242.7 | 193.7 | 152.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 | |
| B. | Na2CO3溶液显碱性,可用于除锅垢中的硫酸钙 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | Na、K合金具有强还原性,可用于原子反应堆的导热剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
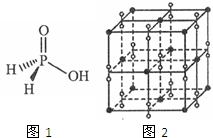 中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.
中学化学常见元素氮、磷、钾与氢、氧、卤素等能形成多种化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com