
| A、质子数:a>c>b>d |
| B、离子的还原性:Y2->Z- |
| C、离子半径:Y2->Z->X+>W3+ |
| D、元素电负性大小顺序:Y>Z |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在很多反应中IBr是强氧化剂 |
| B、IBr与水反应时既做氧化剂,又做还原剂 |
| C、IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D、IBr与NaOH溶液反应时,生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5在空气中形成了气溶胶 |
| B、同温同压条件下,等质量的氧气和臭氧体积比为2:3 |
| C、16g臭氧中含有NA个原子 |
| D、1.00 mol臭氧中含有电子总数为18NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢铁在海水中比在河水中更易腐蚀,主要原因是海水含盐量高于河水 |
| B、NaFeO4自身处理水的原理与明矾和漂白粉共同处理水的原理相同 |
| C、高温或日常用的消毒剂可使H7N9型禽流感病毒蛋白质变性 |
| D、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
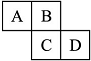 如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的
如图是元素周期表的一部分.A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的| 3 |
| 5 |
| A、气态氢化物的稳定性:A>B |
| B、B元素的两种同素异形体常温下都是气体 |
| C、最高价氧化物对应水化物的酸性:D>C |
| D、原子半径从大到小的排列顺序为:C>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA |
| B、1 L 0.1 mol.L-1的醋酸溶液中氢离子数为0.1 NA |
| C、以惰性电极电解NaCl溶液时,每放出11.2LCl2时,则消耗NaCl个数为NA |
| D、在密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、Mg(HCO3)2溶液与过量NaOH:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- |
| D、次氯酸钙与亚硫酸:Ca2++2ClO-+H2SO3=CaSO3↓+2HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com