
检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
科目:高中化学 来源:2016-2017学年湖北省高一上10月月考化学试卷(解析版) 题型:选择题
在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为( )
A.1:1 B.2:1 C.3:2 D.4:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省大庆市杜蒙县高二上月考一化学卷(解析版) 题型:选择题
在可逆反应中,改变下列条件一定能加快反应速率的是( )
A.增大反应物的量 B.升高温度 C.增大压强 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次月考化学试卷(解析版) 题型:选择题
证明生石灰中既混有石英,又混有石灰石的正确方法是( )
A.加入过量 的盐酸,观察是否有气泡冒出
的盐酸,观察是否有气泡冒出
B.加入过量的烧碱溶液,观察是否有固体溶解
C.加热至高温,观察是否有气泡冒出,是否有硅酸钙生成
D.先加过量的盐酸搅拌,观察是否有不溶物剩余及气泡出现;若有不溶物则滤出,投入到氢氧化钠溶液中看其是否溶解
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次月考化学试卷(解析版) 题型:选择题
某溶液中含有Cu2+、Mg2+、Fe2+、Al3+等4种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加过量盐酸,溶液中大量减少的阳离子是( )
A.Cu2+ B.Mg2+ C.Fe2+ D.Al3+
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.在粗硅的制取中发生2C+SiO2 2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2 CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
查看答案和解析>>
科目:高中化学 来源:2017届吉林省吉林市高三第一次调研化学试卷(解析版) 题型:填空题
某实验小组研究可逆反应AsO43—+2I—+2H+ AsO33—+I2+H2O时,设计了如图所示的原电池:
AsO33—+I2+H2O时,设计了如图所示的原电池:
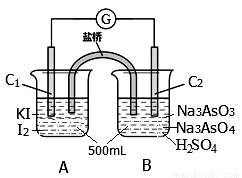
(1)电池工作时,盐桥中的阴离子向 极移动(填C1或C2);若向B池里滴加NaOH溶液,平衡向 方向移动,此时C2极的电极反应式为 。
(2)下 列判断正确的是 。
列判断正确的是 。
a.微安表指针为0时,该反应处于平衡状态。
b.向A池中加入淀粉溶液,溶液变蓝说明该反应处于平衡状态。
c.AsO43—、AsO33—离子浓度相等时,该反应处于平衡状态。
(3)若在5min时间内电路中通过了1.204×104库伦电量,用I—浓度的变化来表示的化学反应速率为 。
(4)该反应的平衡常数表达式K= 。若升高温度,K值增大,则正反应的△H 0。(填“>”、“<”或“=”)
(5)已知反应达到平衡时,AsO43—离子转化率为25%,则I—离子的转化率 。
A.大于25% B.小于25% c.等于25% d无法确定
(6)反应达到平衡后,若将AsO43—、I—、H+、AsO33—、I2的浓度均减少到原来的一半,上述平衡向 方向移动。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆、荆、襄、宜四地七校高三上联考一化学卷(解析版) 题型:填空题
荆门天茂实业集团为新能源领域的先行者,在中南地区拥有最大的甲醇装置并已建成年产50万吨二甲醚装置。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及如下反应。
甲醇合成反应:(i)CO(g)+2H2(g) CH3OH(g)△H1=-90.1kJ•mol-1
CH3OH(g)△H1=-90.1kJ•mol-1
二甲醚合成反应:(ii)2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-23.9kJ•mol-1
CH3OCH3(g)+H2O(g)△H2=-23.9kJ•mol-1
(iii)2CH3OH(g) C2H4(g)+2H2O(g)△H3=-29.1kJ•mol-1
C2H4(g)+2H2O(g)△H3=-29.1kJ•mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上以铝土矿制备较高纯度Al2O3的主要工艺流程是(以化学方程式表示) 、 、2Al(OH)3 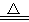 Al2O3 +3H2O。
Al2O3 +3H2O。
(2)一定温度时,反应(i)的平衡常数数值Kp = 4.80×10-2,向容器中充入2 mol H2和1 molCO,反应(i)达平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数为__________(Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(3)二甲醚合成反应过程中两反应能量变化如图所示:
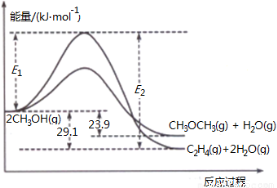
①反应速率较大的是__________(填序号 “ ii”、“ iii”),说明原因 。
②若在容器中加入催化剂,则E2 - E1将__________(填“变大”、“不变”或“变小”)。
(4)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com