
(1)C元素在周期表中的位置是___________________;C在A中燃烧形成的固体中阴阳离子的数目比为_____________;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为_____________________________________________________。
(2)M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且物质的量浓度相等的M、N溶液中水的电离程度,前者小于后者。则M、N分别为_______(填化学式);若将0.1 mol·L-1M和0.2 mol·L-1N两溶液等体积混合,所得溶液中离子浓度的大小顺序为_____________。
(1)第三周期第ⅠA族 1∶2 2NH3![]()
![]() +
+![]()
(2)NaOH,NH4NO3 c(![]() )>c(
)>c(![]() )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
解析:(1)从A和B形成的化合物B2A,可知B的化合价为+1,A的化合价为-2,从而得出A为ⅥA 族元素,再从它能与B形成两种化合物可以确定,A只能为氧元素,B为氢元素。显碱性的分子只有NH3,故D为氮元素。C+的焰色反应呈黄色,则C为钠元素。
(2)A、B、C、D四种元素形成的强电解质中,水溶液显碱性的可能为NaOH或NaNO2,水溶液显酸性的可能为HNO3或NH4NO3。“且物质的量浓度相等的M、N溶液中水的电离程度,前者小于后者”,说明M抑制水电离,而N促进水的电离,也即前者电离出H+或OH-,后者水解生成H+或OH-,从而确定M为NaOH,N为NH4NO3。
将0.1 mol·L-1 NaOH和0.2 mol·L-1 NH4NO3两溶液等体积混合后,发生反应生成NaNO3和NH3·H2O,另有NH4NO3剩余。在![]() 与NH3·H2O共存的溶液中,以弱电解质的电离为主,也即溶液呈碱性。从而得出离子浓度的大小顺序为:c(
与NH3·H2O共存的溶液中,以弱电解质的电离为主,也即溶液呈碱性。从而得出离子浓度的大小顺序为:c(![]() )>c(
)>c(![]() )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)


科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
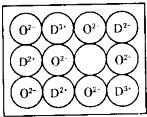 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:专项题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com