
给下列苯的同系物命名
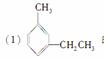 的系统名称为
的系统名称为
________________________________________________________________________。
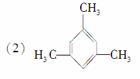 的系统名称为
的系统名称为
________________________________________________________________________。
科目:高中化学 来源: 题型:
被称为“脑黄金”的DHA,是从深海鱼油中提取出的不饱和程度很高的脂肪酸,它的分子中有6个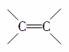 ,称为二十六碳六烯酸,则其甘油酯的分子结构简式为( )
,称为二十六碳六烯酸,则其甘油酯的分子结构简式为( )
A.(C25H51COO)3C3H5 B.(C25H39COO)3C3H5
C.(C26H41COO)3C3H5 D.(C26H47COO)3C3H5
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为__________(填化学式)。
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________(填序号)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:_________________________ + _________________________
上述反应后废水的pH值将________(填“增大”、“减小”或“不变”)。
(4)向20mL 0.01mol·L-1的NaNO2溶液中加入10mL 0.01 mol·L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=________________________________。(已知:KSP(AgNO2)=2×10-8 mol2·L-2)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:某温度时,KW=1.0×10-12。在该温度下,测得0.1mol·L-1Na2A溶液PH=6,则下列说法正确的是
A.H2A在水溶液中的电离方程式为:H2A=H++HA-,HA-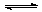 H++A2-
H++A2-
B.常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-)
C.相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等
D.0.0l mol·L-l的NaHA溶液pH>2
查看答案和解析>>
科目:高中化学 来源: 题型:
黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
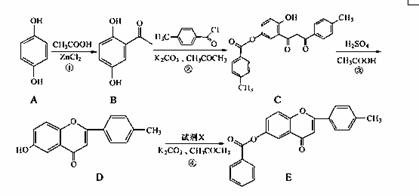
请回答下列问题:
(1)化合物B中的含氧官能团为 和 (填名称)。
(2)反应③中涉及到的反应类型有水解反应、 和 。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为 。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(5)写出反应①的化学方程式 。
(6)已知: 。
。
根据已有知识并结合相关信息,写出以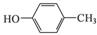 和CH3COOH为原料制备
和CH3COOH为原料制备
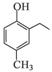 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
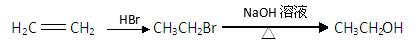
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O  4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH)3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
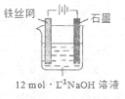
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为 ,正极反应为: 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L,含有2.0×l0-4 mol·L-l K2FeO4的废水中有CaFeO4沉淀产生,理论上至少加入Ca(OH)2的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
、三氟化氮(NF3)是无色无味气体,它可由氨气和氟气反应制得:4NH3+3F2===NF3+3NH4F。下列说法正确的是
A、NH4F的还原性比NH3强
B、NF3的氧化性比F2强
C、该反应中被氧化和被还原物质的物质的量之比为4∶3
D、该反应中得到1 mol NF3时,转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
1808年,英国化学家用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁作为一种强氧化剂,还用于钛、铍和铀的生产中。
(1)镁在元素周期表中的位置为_________________________.
(2)写出用镁与金红石(主要成分为Ti O2)在加热条件下制取钛的化学方程式:_____________________________________.
(3)镁在加热的条件下还能与NaOH固体反应,生成MgO和单质X、单质Y。已知X与水反应可生成单质Y,则镁与NaOH反应的化学方程式为____________________.
(4)镁—过氧化氢电池的工作原理如图所示,该电池放电时总反应的化学方程式为______________________________________.
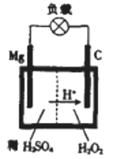
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com