
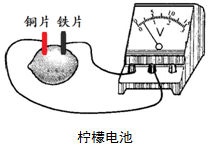
| A. | 铜片上发生反应:Cu-2e-═Cu2+ | B. | 铁片是负极,其质量逐渐减小 | ||
| C. | 电流由铁片经导线流向铜片 | D. | 柠檬中蕴含的电能转化为化学能 |
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol的  与足量的NaOH溶液反应,能消耗3mol NaOH 与足量的NaOH溶液反应,能消耗3mol NaOH | |
| B. | 可用氢氧化钠溶液除去乙酸乙酯中残留的乙酸 | |
| C. | 间二甲苯也叫1,5-二甲苯 | |
| D. | 乙二醇和丙三醇互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量二氧化碳通入“水玻璃”中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| B. | 碳酸钙与稀盐酸混合:CO32-+2H+═CO2↑+H2O | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Al2O3溶于NaOH溶液中:Al2O3+2OH-═2[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 原因分析 |
| A | 久置的浓硝酸呈黄色 | 浓硝酸不稳定,分解生成的NO2 溶解在其中 |
| B | 铝片先用砂纸打磨,再加入到浓硝酸中,无明显现象 | 浓硝酸具有强氧化性,常温下,铝被浓硝酸钝化 |
| C | SO2通入酸性高锰酸钾溶液中,溶液紫红色褪去 | SO2具有漂白性,使其褪色 |
| D | 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 | 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
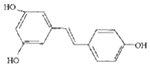 ,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )
,广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性.能够跟1mol该化合物起反应的Br2或H2的最大用量分别是( )| A. | 1mol,1mol | B. | 3.5mol,7mol | C. | 3.5mol,6mol | D. | 6mol,7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2v(NH3)=v(CO2) | |
| B. | 密闭容器中总压强不变 | |
| C. | 密闭容器中混合气体的密度不变 | |
| D. | 密闭容器中混合气体的平均摩尔质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
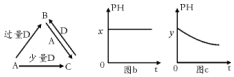
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
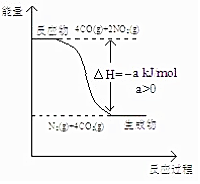 研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义.
研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com