
| A. | SO2与SO3互为同分异构体 | |
| B. | 氢气是理想的绿色能源 | |
| C. | 单质中不存在化学键 | |
| D. | 电解饱和氯化钠溶液可能得到金属钠 |
科目:高中化学 来源: 题型:实验题
| 组别 | 实验温度 (℃) | H2O2溶液 | FeCl3溶液 (1mol/L) |
| 1 | 30 | 5mL 4% | 1mL |
| 2 | 60 | 5mL 4% | 1mL |
| 3 | 30 | 5mL 12% | |
| 4 | 30 | 5mL 4% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应或用途 | 性质或结论 |
| A | 常温下,碳能与浓硝酸剧烈反应 | 浓硝酸具有强氧化性 |
| B | SiO2既能与氢氟酸反应,又能与氢氧化钠溶液反应 | SiO2是两性氧化物 |
| C | 氯水能使红色石蕊试纸变白 | 氯水具有漂白性 |
| D | 向含有酚酞的FeCl3溶液中滴入KSCN溶液,溶液变红色 | KSCN溶液呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
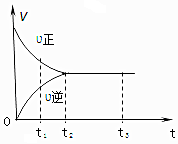 如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应:X2+3Y2?2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,反应只向正方向进行 | B. | t2时,反应未达到限度 | ||
| C. | t2~t3,反应已停止进行 | D. | t2~t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
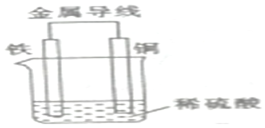 现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:
现有反应:①Ba(OH)2•8H2O+2NH4Cl═2NH3↑+BaCl2+10H2O,②Fe+H2SO4═FeSO4+H2↑.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
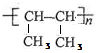 .
.
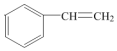 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8×l0-7mol/L | B. | 1.0×l0-5mol/L | C. | 1.0×l0-7mol/L | D. | 1.8×l0-9mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com