
| A.碳酸钠的热稳定性比碳酸氢钠强 |
| B.相同温度时,碳酸钠的溶解度大于碳酸氢钠 |
| C.同温度、同物质的量浓度时,碳酸钠溶液碱性大于碳酸氢钠溶液 |
| D.碳酸氢钠一定条件下可转化为碳酸钠,但碳酸钠不能转化为碳酸氢钠 |
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
| A.反应过程中得到6.72L的气体(标准状况下) |
| B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
| C.最终得到7.8g的沉淀 |
| D.最终得到的溶液中c(NaCl)=1.6 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
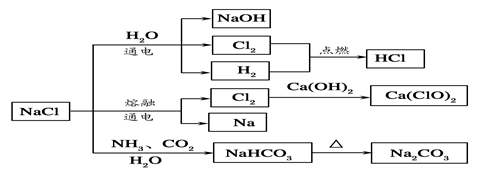
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳和Cl2反应可制得漂白粉,其主要成分是次氯酸钙 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.如图所示转化反应不都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| | ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2CO3 | B.Na2O2,Na2CO3 |
| C.NaOH,Na2CO3 | D.Na2O2,NaOH,Na2CO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3 |
| B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气 |
| C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
| D.钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com