
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物
请填空:
(1)X、Y、Z原子最外层电子数之和是________
(2)X2W的结构式是________
(3)X、Y和Z组成的一种化合物是强酸.写出该酸的稀溶液与铜反应的离子方程式:
________________________________________________________________________
含Y、Z的气体和一种只含X、Z的液体(在常温、常压下)反应可以生成一种离子化合物其化学式为________
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1;该化合物具有
还原性。
① 写出该化合物与过量稀NaOH溶液反应的离子方程式:
________________________________________________________________________.
② 请设计实验证明该化合物具有还原性:
________________________________________________________________________。
(9分) (1)12(1分)(2)H—??—H(1分)
(3)3Cu+ 8H++2NO=3Cu2++2NO↑+4H2O(2分) NH4NO3或NH4NO2(1分)
(4) ①NH+HSO+2OH-=NH3·H2O+H2O+SO(2分)
②取少许氯水,滴加该溶液,氯水褪色则说明该化合物具有还原性(KMnO4、溴水、
Fe3+等均可) (2分)
解析试题分析:X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物。这说明Y、Z是第二周期元素,W是第三周期元素。因此X是H,则Y是N,Z是O、W是S。
(1)X、Y、Z原子最外层电子数之和是1+5+6=12。
(2)H2S的结构和水的结构相似,则H2S的结构式是H—??—H。
(3)X、Y和Z组成的一种化合物是强酸,则该强酸是硝酸。硝酸具有强氧化性,能和铜发生氧化还原反应,则硝酸的稀溶液与铜反应的离子方程式3Cu+ 8H++2NO=3Cu2++2NO↑+4H2O。含H、N、O三种元素的一种离子化合物的化学式为NH4NO3或NH4NO2。
(4)①X、Y、Z和W组成一种化合物,其原子个数之比为5∶1∶3∶1,则该化合物是NH4HSO3,与过量稀NaOH溶液反应的离子方程式是NH+HSO+2OH-=NH3·H2O+H2O+SO。
②+4价的S元素具有还原性,所以验证其还原性的实验方法是取少许氯水,滴加该溶液,氯水褪色则说明该化合物具有还原性。
考点:考查元素的推断、结构式、方程式以及氧化性和还原性的检验等
点评:该题是中等难度的试题,试题贴近高考,基础性强,在注重对学生基础知识检验和训练的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力。准确判断出元素是答题的关键。


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:填空题
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示, x越大,其原子吸引电子的能力越强。 下面是某些短周期元素的x值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、G五种元素分属三个不同短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。Y2是空气的主要成分之一。请回答下列问题:
(1)M在元素周期表中的位置为________________ 。
(2)Y、Z的单质或两元素之间形成的化合物共有________种;Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (写出两种物质的化学式)
(3)上述五种元素中两元素形成的化合物之间可相互反应生成单质M的化学方程式为
。
(4)ZX与水反应放出气体的化学方程式为___________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有原子序数依次增大的五种短周期元素A、B、C、D、E,已知 A、E同主族,A在所有元素中原子结构最简单,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y;A、B、C、E四种元素都能与D元素分别形成原子个数比不相同的常见化合物,回答下列问题:
(1)B在周期表中的位置是 ,E的原子结构示意图 。
(2)A与C形成化合物中含有的化学键属于(填“极性键”或“非极性键”) 。
(3)用电子式表示化合物E2D的形成过程 。
(4)C元素的最高价氧化物的水化物与其氢化物反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和MgSO4)中提取金属镁的主要步骤如下:
回答下列问题:
(1)Mg在周期表中的位置______________________,试剂A可以选用_____________________,试剂C可选用_______________________;
(2)步骤①的离子方程式_________________________________________;
(3)用电子式表示氯化镁的形成过程_______________________________;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为:_____________________________________________________;
(5)戴维制镁的化学方程式为_____________________________________;
(6)配平下列反应的方程式。
① 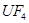 +
+ 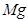 ——
——  +
+ 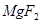
② 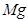 +
+ 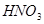 ——
—— 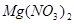 +
+ 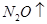 +
+ 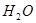
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为______________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO ________ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为_______________、_______________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_______________;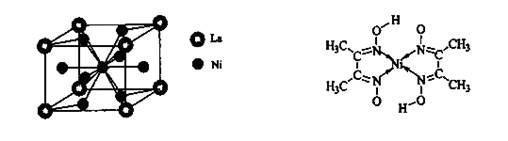
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是 键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
键,碳氮之间的共价键类型是______________,氮镍之间形成的化学键是_______________;
②该结构中,氧氢之间除共价键外还可存在_______________;
③该结构中,碳原子的杂化轨道类型有_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某元素的核素为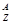 X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
X,其氯化物XCl2 1.11 g配成溶液后,需用20 mL 1 mol·L-1的AgNO3溶液才能把氯离子完全沉淀下来。已知X核素中有20个中子。
(1)计算X的质量数为多少?
(2)指出X元素在周期表中的位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com