
 ��
��
���� ��1���������������ƣ���NaOH��Ӧ���������Σ�
��2���ö��ߡ�-����ʾ���õ��Ӷԣ��á��E����ʾδ�ɼ��¶Ե��ӵ�ʽ�ӽ�·��˹�ṹʽ��
��3������������ԭ��Ӧ����CuCN�����壻�����������CN-��������������ӣ�
��4��Ư��ʹCN-ת��Ϊ�������ʣ�����������ԭ��Ӧ����̼��������ӡ������ӡ�������
��� �⣺��1����������NaOH�ķ�Ӧ��֪��CN��2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ��CN��2+2NaOH=NaCN+NaOCN+H2O���ʴ�Ϊ����CN��2+2NaOH=NaCN+NaOCN+H2O��
��2��CN-����CN��2��·��˹�ṹʽ�ֱ�Ϊ ��
�� ��
��
�ʴ�Ϊ�� ��
�� ��
��
��3������������ԭ��Ӧ����CuCN�����壻�����������CN-��������������ӣ����������ӷ�Ӧ�ֱ�Ϊ4CN-+2Cu2+=2CuCN��+��CN��2����CuCN+3CN-=Cu��CN��43-��
�ʴ�Ϊ��4CN-+2Cu2+=2CuCN��+��CN��2����CuCN+3CN-=Cu��CN��43-��
��4��Ư��ʹCN-ת��Ϊ�������ʣ�����������ԭ��Ӧ����̼��������ӡ������ӡ����������ӷ�ӦΪ2CN-+5ClO-+H2O=2HCO3-+N2+5Cl-��
�ʴ�Ϊ��2CN-+5ClO-+H2O=2HCO3-+N2+5Cl-��
���� ���⿼����±�����ʵ����ʣ�����ϰ���е���Ϣ��������ԭ��Ӧ�������֪ʶΪ���Ĺؼ������ط�����Ǩ��Ӧ�������Ŀ��飬��Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -��0.4 mol����H1+0.05 mol����H3�� | B�� | -��0.4 mol����H1+0.05 mol����H2�� | ||
| C�� | -��0.4 mol����H1+0.1 mol����H3�� | D�� | -��0.4 mol����H1+0.1 mol����H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol�κ����ʶ�����6.02��1023������ | |
| B�� | 12g 12C�к���Լ6.02��1023��̼���� | |
| C�� | 1 molˮ�к���2 mol��Ԫ�غ�1 mol��Ԫ�� | |
| D�� | 1 mol Ne�к���Լ6.02��1024������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | +2 | B�� | +3 | C�� | +4 | D�� | +5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ��0.1mol��þ�������������100mL 2mol/LH2SO4��Һ�У�Ȼ���ٵμ�1mol/L NaOH��Һ�����ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯��ͼ��ʾ����V1=160mLʱ����V2Ϊ��������
��0.1mol��þ�������������100mL 2mol/LH2SO4��Һ�У�Ȼ���ٵμ�1mol/L NaOH��Һ�����ڵμ�NaOH��Һ�Ĺ����У���������m�����NaOH��Һ�����V�仯��ͼ��ʾ����V1=160mLʱ����V2Ϊ��������| A�� | 240mL | B�� | 300mL | C�� | 400mL | D�� | 440mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƿ�������ѹǿ���� | |
| B�� | ƿ��������ɫ��dz | |
| C�� | ����ΪCH3Cl��CH2Cl2��CHCl3��CCl4��HCl | |
| D�� | ��պ��Ũ��ˮ�IJ�������ƿ�ڻ���ְ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ��Ŀ�� | ʵ����� |
| A | ֤����ϩ�л�ԭ�� | ����ϩ����ͨ������KMnO4��Һ�� |
| B | �Ƚ�H2O���Ҵ����ǻ���Ļ����� | �ֱ��������Na |
| C | �����������е���ԭ�� | ����NaOH��Һ�����ȣ�Ȼ�����AgNO3��Һ |
| D | ����1-������2-���� | �˴Ź������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
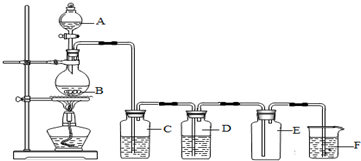
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
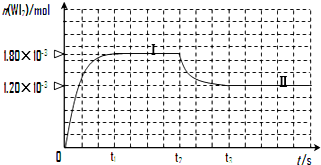 ���ٵƾ���ʹ�������������ܻ������ŵ㣮һ���¶��£��ڵ��ٵƵ����ڷ���������������ڵ��ݱ��ϵ��ٿ��Է������µĿ��淴Ӧ��W��s��+I2��g��?WI2��g��
���ٵƾ���ʹ�������������ܻ������ŵ㣮һ���¶��£��ڵ��ٵƵ����ڷ���������������ڵ��ݱ��ϵ��ٿ��Է������µĿ��淴Ӧ��W��s��+I2��g��?WI2��g���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com