
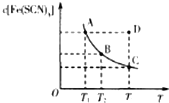
 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是( )| A. | A点与B点相比,A点的血红色沉淀更多 | |
| B. | 加入KCl固体可以使溶液由D点变到C点 | |
| C. | 反应处于D点时,一定有V(正)<V(逆) | |
| D. | 若T1、T2温度下的平衡常数分别为K1、K2,K1<K2 |
分析 A.生成为Fe(SCN)3(aq)络合物,不是沉淀;
B.KCl不影响该可逆反应;
C.温度相等时,D点硫氰化铁的浓度大于平衡时C,则此时平衡向着逆向移动;
D.根据T1、T2时硫氰化铁的浓度大小判断平衡常数大小.
解答 解:A.该反应生成的硫氰化铁不是沉淀,故A错误;
B.反应FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq)之间KCl不影响化学平衡,故B错误;
C.根据图象可知,D点Fe(SCN)3的浓度大于平衡时C在,则此时平衡向着逆向移动,V(正)<V(逆),故C正确;
D.根据图象可知,温度T1时硫氰化铁的浓度大于T2,则平衡常数K1>K2,故D错误;
故选C.
点评 本题考查了化学平衡及其影响,题目难度中等,正确分析图象得出曲线变化的含义为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 检验自来水中是否含Cl- | B. | 检验鸡蛋壳(CaCO3)能否溶于酸 | ||
| C. | 鉴别AgNO3 溶液和BaCl2 溶液 | D. | 除去热水瓶内壁上的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
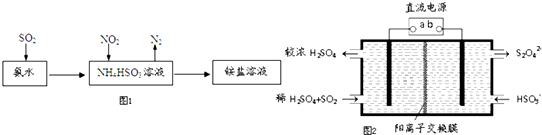 SO2和NOx都是大气污染物.
SO2和NOx都是大气污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
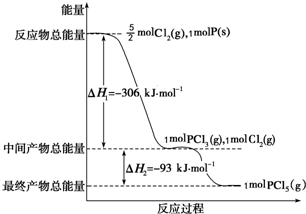 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
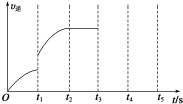 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com