
下列关于Na及其化合物的叙述正确的是
A.将钠投入FeSO4溶液中,可以得到单质铁
B.足量Cl2、S分别和二份质量相等的Na反应,前者得到电子多
C. 2Na2O2+2H2O=4NaOH+ O2↑反应中,生成lmolO2,转移2mole-
D.鉴别Na2CO3和NaHCO3溶液可使用澄清石灰水,前者溶液变浑浊.后者无现象
科目:高中化学 来源:2016-2017学年西藏林芝一中高一上期末化学试卷(解析版) 题型:选择题
物质能够表现出多种性质,也对应着多种分类方法。下列说法正确的是( )
A.由同种元素组成的物质一定是纯净物
B.CO是非金属氧化物,也是是酸性氧化物
C.稀豆浆是常见的胶体,故能发生丁达尔效应
D.有单质参加的化学反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一12月月考化学卷(解析版) 题型:实验题
聚合硫酸铁(简称PFS,化学式为[Fe(OH)n(SO4)3-n/2]m )是一种新型高效的无机高分子絮凝剂,广泛用于水的处理,现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁。实验步骤如下: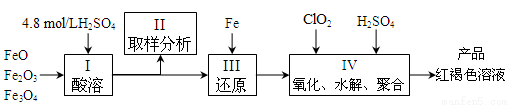
(1)实验室用18.4mol/L的浓硫酸配制250mL4.8mol/L的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需的玻璃仪器__________。定容操作中若俯视容量瓶刻度线,所配硫酸溶液浓度将___________(填“偏高”、“偏低”或“无影响”)
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_______。
A.确定下一步还原所需铁的量 B.控制溶液中Fe2+与Fe3+含量比
C.确定氧化Fe2+所需ClO2的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用ClO2氧化Fe2+时的离子方程式:____________________。(还原产物为Cl-)
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+物质的量之比,有人设计了以下操作:
(I)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤,洗涤、干燥后,称重,其质量为mg。
(II)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL与0.1000 mol/L V mL KMnO4酸性溶液恰好完全反应,MnO4-被还原为Mn2+。
回答下列问题:
① 根据(II)步骤中判断Cu2+、Fe2+、MnO4-、Fe3+氧化性由强到弱的顺序:__________。
② 聚合硫酸铁中SO42-与Fe3+的物质的量之比为____________(用含m、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一12月月考化学卷(解析版) 题型:选择题
己知下述三个实验均能发生化学反应①将铁钉放入硫酸铜溶液中 ②向硫酸亚铁溶液中滴入几滴氯水 ③将铜丝放入氯化铁溶液中下列判断正确的是
A.实验①中铁钉做氧化剂 B.实验②中Fe2+其有还原性
C.实验③中发生的是置换反应 D.上述实验证明氧化性:Fe3+> Fe2+>Cu2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一12月月考化学卷(解析版) 题型:选择题
下列做法正确的是
A. 保存FeSO4溶液需加少量Fe 粉防止溶质被氧化
B. 分离溶于水中的碘,用有机溶剂乙醇萃取分液即可
C. 若钠、过氧化钠着火用干粉灭火器灭火
D. 某无色溶液中加BaCl2溶液,再加稀盐酸,沉淀不溶解,则原溶液中含SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上期中化学卷(解析版) 题型:填空题
焦亚硫酸钠(Na2S2O5)是常用食品抗氧化剂,常用于葡萄酒、果脯等食品中。
(1)Na2S2O5中硫元素的化合价是________,焦亚硫酸钠在空气中久置会与氧气反应生成连二硫酸钠 (Na2S2O6), 写出该反应的化学方程式,并标出该反应电子的转移方向和数目_________________;
(2)葡萄酒中的 Na2S2O5的使用量是以游离的 SO2 来计算的,SO2 的摩尔质量________。我国规定每升葡萄酒中SO2的最高含量是 0.25g,则一瓶 800mL 的葡萄酒中 SO2的物质的量不能超过___________(精确到 0.001 );
(3)世界卫生组织规定按照体重计算,每人每天摄入SO2的最大量应控制在 0.7mg/kg,如果一个人体重是60kg,那么他每天喝上述葡萄酒的量不超过 __________mL 就不会造成健康上的问题。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上期中化学卷(解析版) 题型:选择题
宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2=2X+2H2O,其中H2S是
A.既不是氧化剂又不是还原剂 B.还原剂
C.既是氧化剂又是还原剂 D.氧化剂
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市等五校高二上联考二化学试卷(解析版) 题型:填空题
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g) CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g)  CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
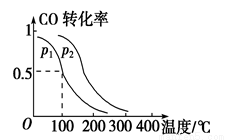
p2 p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com