
| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O | D. | Fe+CuSO4═Cu+FeSO4 |
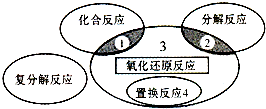
分析 由图可知,区域3属于氧化还原反应,但不属于置换反应、化合反应和分解反应.而有元素化合价变化的反应为氧化还原反应,单质与化合物反应生成单质与化合物的反应为置换反应,两种或多种物质生成一种物质的为化合反应,一种物质生成两种或多种物质的为分解反应,以此来解答.
解答 解:A、此反应属于氧化还原反应,但同时属于化合反应,故A错误;
B、此反应属于氧化还原反应,但同时属于分解反应,故B错误;
C、此反应是氧化还原反应,同时不是置换反应、化合反应和分解反应,故C正确;
D、此反应是氧化还原反应,但同时是置换反应,故D错误.
故选C.
点评 本题考查氧化还原反应及四种基本反应类型,明确反应的分类及反应中元素的化合价变化是解答本题的关键,题目难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学危险品发生爆炸事故后,人员应该向上风方向撤离 | |
| B. | 含有硫酸的工业废水用硝酸钡处理后再排放有利于减少水体污染 | |
| C. | 用聚苯乙烯代替聚乙烯作食品包装袋,可节约成本,但是不利于人体健康和环保 | |
| D. | “阅兵蓝”的出现说明京津冀实施道路限行和污染企业停工等措施,可以有效地减轻雾霾和保证空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4bc}{a}$NAL | B. | $\frac{22.4ab}{c}$NAL | C. | $\frac{22.4ac}{b}$NAL | D. | $\frac{22.4b}{ac}$NA L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧瓶、锥形瓶、蒸发皿加热时均需要垫上石棉网 | |
| B. | 分液漏斗、滴定管、容量瓶使用前均需要检查是否漏水 | |
| C. | 配制1 mol•L-1NaCl溶液、测定Na2CO3溶液的pH、焰色反应实验均需要用到玻璃棒 | |
| D. | 乙酸乙酯、硝基苯的制备、银镜反应实验均需要水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性的合成洗涤剂 | B. | 肥皂 | ||
| C. | 中性的合成洗涤剂 | D. | 纯碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 4.2g | C. | 8.4g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若所得溶液呈中性,则生成的盐可能为强酸强碱盐 | |
| B. | 若所得溶液呈碱性,则一定是强碱与弱酸溶液反应 | |
| C. | 若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 | |
| D. | 若所得溶液的pH=9,则水电离产生的c(OH-)可能为10-9mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com