
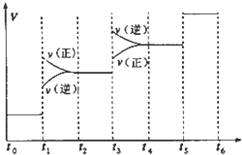
 ĒāĘųŹĒŗĻ³É°±µÄÖŲŅŖŌĮĻ£¬ŗĻ³É°±·“Ó¦µÄČČ»Æ·½³ĢŹ½ČēĻĀ£ŗ
ĒāĘųŹĒŗĻ³É°±µÄÖŲŅŖŌĮĻ£¬ŗĻ³É°±·“Ó¦µÄČČ»Æ·½³ĢŹ½ČēĻĀ£ŗ| A£® | Ķ¼ÖŠt1Ź±ŅżĘšĘ½ŗāŅĘ¶ÆµÄĢõ¼žæÉÄÜŹĒÉżøßĪĀ¶Č | |
| B£® | ±ķŹ¾Ę½ŗā»ģŗĻĪļÖŠNH3µÄŗ¬Įæ×īøßµÄŅ»¶ĪŹ±¼äŹĒt5”«t6 | |
| C£® | ĪĀ¶ČĪŖT”ꏱ£¬½«2amolH2ŗĶamolN2·ÅČė0.5LĆܱÕČŻĘ÷ÖŠ£¬³ä·Ö·“Ó¦ŗó²āµĆN2µÄ×Ŗ»ÆĀŹĪŖ50%£®Ōņ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ$\frac{16}{{a}_{2}}$ | |
| D£® | ŌŚt2”«t3Ź±¼ä¶Ī£¬±£³ÖČŻĘ÷Ģå»ż²»±ä£¬³äČėŅ»¶ØĮæµÄ¶čŠŌĘųĢ壬N2µÄÅØ¶Č²»±ä |
·ÖĪö A”¢ÓÉ·“Ó¦ĖŁĀŹÓėŹ±¼äµÄ¹ŲĻµĶ¼ĻóæÉÖŖ£¬t1Ź±ÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬ŅżĘšĘ½ŗāŅĘ¶ÆµÄĢõ¼žæÉÄÜŹĒŌö“óŃ¹Ē棻
B”¢t3Ź±æĢÕżÄę·“Ó¦ĖŁĀŹ¾łŃøĖŁŌö“󣬵«ŹĒĘ½ŗāÄęĻņ½ųŠŠ£¬ĖłŅŌ°±ĘųµÄ°Ł·Öŗ¬ĮæŹĒ¼õŠ”µÄ£¬¼“±ķŹ¾Ę½ŗā»ģŗĻĪļÖŠNH3µÄŗ¬Įæ×īøßµÄŅ»¶ĪŹ±¼äŹĒt2-t3£»
C”¢N2£Øg£©+3H2£Øg£©?2NH2£Øg£©
æŖŹ¼ 2amol/L 4amol/L 0
·“Ó¦ amol/L 3amol/L 2amol/L
Ę½ŗā amol/L amol/L 2amol/L
øł¾Ż»ÆŃ§Ę½ŗā³£Źż±ķ“ļŹ½½ųŠŠ¼ĘĖć£»
D”¢ŌŚt2”«t3Ź±¼ä¶Ī£¬±£³ÖČŻĘ÷Ģå»ż²»±ä£¬³äČėŅ»¶ØĮæµÄ¶čŠŌĘųĢ壬ø÷×é·ÖµÄÅØ¶Č²»±ä£¬Ę½ŗā²»ŅĘ¶Æ£®
½ā“š ½ā£ŗA”¢ÓÉ·“Ó¦ĖŁĀŹÓėŹ±¼äµÄ¹ŲĻµĶ¼ĻóæÉÖŖ£¬t1Ź±ÕżÄę·“Ó¦ĖŁĀŹ¶¼Ōö“ó£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬ŅżĘšĘ½ŗāŅĘ¶ÆµÄĢõ¼žæÉÄÜŹĒŌö“óŃ¹Ē棬¶ų²»ŹĒÉżøßĪĀ¶Č£¬¹ŹA“ķĪó£»
B”¢t3Ź±æĢÕżÄę·“Ó¦ĖŁĀŹ¾łŃøĖŁŌö“󣬵«ŹĒĘ½ŗāÄęĻņ½ųŠŠ£¬ĖłŅŌ°±ĘųµÄ°Ł·Öŗ¬ĮæŹĒ¼õŠ”µÄ£¬¼“±ķŹ¾Ę½ŗā»ģŗĻĪļÖŠNH3µÄŗ¬Įæ×īøßµÄŅ»¶ĪŹ±¼äŹĒt2-t3£¬¶ų²»ŹĒt5”«t6£¬¹ŹB“ķĪó£»
C”¢N2£Øg£©+3H2£Øg£©?2NH2£Øg£©
æŖŹ¼ 2amol/L 4amol/L 0
·“Ó¦ amol/L 3amol/L 2amol/L
Ę½ŗā amol/L amol/L 2amol/L
ĖłŅŌ»ÆŃ§Ę½ŗā³£ŹżK=$\frac{£Ø2amol/L£©^{2}}{£Øamol/L£©”Į£Øamol/L£©^{3}}$=$\frac{4}{{a}^{2}}$£ØL/mol£©2£¬¹ŹC“ķĪó£»
D”¢ŌŚt2”«t3Ź±¼ä¶Ī£¬±£³ÖČŻĘ÷Ģå»ż²»±ä£¬³äČėŅ»¶ØĮæµÄ¶čŠŌĘųĢ壬ø÷×é·ÖµÄÅØ¶Č²»±ä£¬Ę½ŗā²»ŅĘ¶Æ£¬ĖłŅŌµŖĘųµÄÅØ¶Č²»±ä£¬¹ŹDÕżČ·£»
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²éĮĖÓ°Ļģ»Æѧ·“Ó¦ĖŁĀŹµÄŅņĖŲ”¢Ķ¼Ļó·ÖĪö£¬»ÆŃ§Ę½ŗāČż¶ĪŹ½¼ĘĖćµČÖŖŹ¶µć£¬×¢ŅāÖŖŹ¶µÄĒØŅĘŗĶÓ¦ÓĆŹĒ¹Ų¼ü£¬ÄŃ¶Č²»“ó£®


 »„¶ÆÓ¢ÓļĻµĮŠ“š°ø
»„¶ÆÓ¢ÓļĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
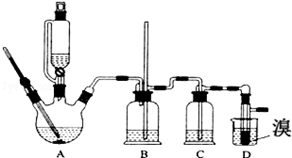
| ŅŅ“¼ | 1£¬2-¶žäåŅŅĶé | ŅŅĆŃ | |
| דĢ¬ | ĪŽÉ«ŅŗĢå | ĪŽÉ«ŅŗĢå | ĪŽÉ«ŅŗĢå |
| ĆܶČ/g•cm-3 | 0.79 | 2.2 | 0.71 |
| ·Šµć/”ę | 78.5 | 132 | 34.6 |
| ČŪµć/”ę | Ņ»l30 | 9 | -1l6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé²½Öč | ²Ł×÷·½·Ø | ŹµŃéĻÖĻó | ½įĀŪ»ņ½āŹĶ |
| 1 | ¹Ū²ģĀČĖ®µÄŃÕÉ« | ŗ¬ÓŠCl2 | |
| 2 | ÓŠĪŽÉ«ĘųĢå²śÉś | ŗ¬ÓŠH+ | |
| 3 | ȔɣĮæĀČĖ®ÓŚŹŌ¹ÜÖŠ£¬¼ÓČėĻ”ĻõĖįĖį»ÆµÄĻõĖįŅųČÜŅŗ | ÓŠ°×É«³ĮµķÉś³É | |
| 4 | ȔɣĮæĀČĖ®ÓŚŹŌ¹ÜÖŠ£¬·ÅČėŗģÉ«²¼Ģõ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | c£ØNH4+£©£¾c£ØCl-£©£¾c£ØOH-£©£¾c£Ø H+£© | B£® | c£ØCl-£©£¾c£ØNH4+£©£¾c£Ø H+£©£¾c£ØOH-£© | ||
| C£® | c£ØNH4+£©+c£Ø NH3£©=c£ØCl-£©+c£ØOH-£© | D£® | c£ØNH4+£©+c£Ø NH3•H2O£©+c£Ø NH3£©=c£ØCl-£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ½šŹōĄė×Ó | Fe3+ | Al3+ | Fe2+ |
| æŖŹ¼³ĮµķµÄpH | 2.2 | 3.1 | 7.5 |
| ĶźČ«³ĮµķµÄpH | 3.5 | 5.4 | 9.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ČÜŅŗÖŠµÄ»Æѧ·“Ó¦“󶹏ĒĄė×Ó·“Ó¦£®øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£®
ČÜŅŗÖŠµÄ»Æѧ·“Ó¦“󶹏ĒĄė×Ó·“Ó¦£®øł¾ŻŅŖĒó»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
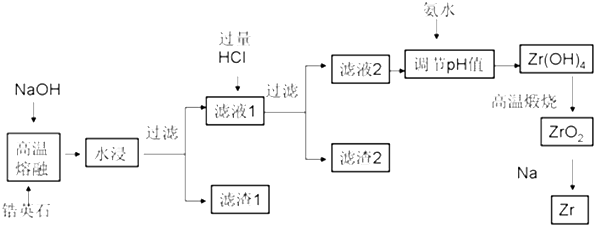
| ³ĮµķĪļ | Zr£ØOH£©4 | Fe£ØOH£©3 | Al£ØOH£©3 | Fe£ØOH£©2 |
| æŖŹ¼³ĮµķŹ±pH | 1.2 | 2.7 | 3.4 | 6.3 |
| ĶźČ«³ĮµķŹ±pH | 2.4 | 3.2 | 5.2 | 9.7 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ū | B£® | ¢Ł¢Ś | C£® | ¢Ł¢Ū | D£® | ¢Ł¢Ü |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com