
| A.同周期元素中X的金属性最强 | B.同族元素中Z的氢化物沸点最高 |
| C.原子半径X>Y,离子半径X+> Z2— | D.Y的单质和氧化物有相同的晶体类型 |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 :
: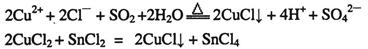
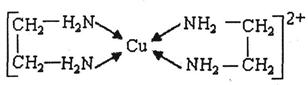
 。
。 中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。
中氮原子轨道的杂化类型为 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_ 。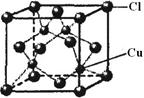
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种分子中心原子的杂化类型不同 |
| B.两种分子中键的极性和分子的极性不同 |
| C.NH3分子中存在有一对未成键的孤对电子 |
| D.氨气分子之间和甲烷分子之间的作用力类型不同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
氧化剂或氯化剂,能与许多有机物反应。请回答下列问题: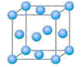
 分子的空间构型是_______。
分子的空间构型是_______。 成的合金。
成的合金。 态碳(C)原子的价电子排布式为 。
态碳(C)原子的价电子排布式为 。 )4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 , Ni(CO)4易溶于 (填序号)。
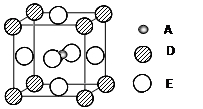
)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 , Ni(CO)4易溶于 (填序号)。 种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中
种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中 每个镁原子周围距离最近的镍原子有 个。
每个镁原子周围距离最近的镍原子有 个。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2的化学性质比O2稳定 | B.HNO3易挥发,H2SO4难挥发 |
| C.常温、常压下,溴呈液态,碘呈固态 | D.稀有气体很难发生化学反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红磷与白磷互为同分异构体 |
| B.C3H6与C5H10一定互为同系物 |
| C.HCl、NH3、CO2均是极性分子 |
| D.氯化钠晶体、冰、金刚石是不同类型的晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com