
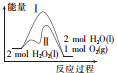
| A. | 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰 | |
| B. | 2 molH2O2(l)的能量高于2 molH2O(l)的能量 | |
| C. | 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ | |
| D. | 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ |
分析 A、途径II的活化能小于途径I;
B、由图可知:反应物的总能量高于生成物的总能量;
C、催化剂只改变速率,不改变反应的热效应;
D、途径II化学反应速率快,据此解答即可.
解答 解:A、由图可知,途径II的活化能减小,可能加入了催化剂,故A正确;
B、此反应为放热反应,即2mol双氧水的总能量高于2molH2O和1molO2的能量之和,那么2 molH2O2(l)的能量高于2 molH2O(l)的能量也正确,故B正确;
C、催化剂只改变化学反应速率,不改变△H,故C错误;
D、途径II加入催化剂,化学反应速率加快,到达平衡的时间缩短,故D正确,
故选C.
点评 本题主要考查的是放热反应与吸热反应的判断,涉及活化能、催化剂影响等知识点,难度不大.


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:多选题
| A. | 电解饱和食盐水可制得金属钠 | B. | 海带提碘只涉及物理变化 | ||
| C. | 海水提溴涉及到氧化还原反应 | D. | 海水提镁涉及到复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
,水杨酸酯E为紫外吸收剂,可用于配制防晒霜.E的一种合成路线如下:
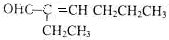 ;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键;
;若只能一次取样,请提出检验C中2种官能团的简要方案:用银氨溶液先检验醛基,再加稀盐酸使溶液呈酸性后,加溴水检验碳碳双键; 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、 ;
; :
:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
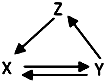 如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
如表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )| X | Y | Z | |
| ① | SiO2 | H2SiO3 | Na2SiO3 |
| ② | CH3CH2OH | CH3CHO | CH2=CH2 |
| ③ | AlCl3 | Al(OH)3 | Al2O3 |
| ④ | NO | NO2 | HNO3 |
| ⑤ | FeCl2 | Fe | FeCl3 |
| A. | ③④⑤ | B. | ②③④ | C. | ④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Ba2+、NO3- | B. | Al3+、AlO2-、HCO3-、Na+ | ||
| C. | Na+、Fe3+、SO42-、I- | D. | Fe3+、SCN-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| B. | 100mL 18.4mol•L-1 的浓硫酸与足量的铜加热反应后,生成SO2 分子数为0.92NA | |
| C. | 将CO2 通过Na2O2 ,当固体质量增加a g时,反应中转移的电子数为a$\frac{{N}_{A}}{28}$ | |
| D. | 标准状况下,11.2L正丁烷所含公用电子对数为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 13种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com