
| A. | (CH3)2 CH CH2CH2CH3B | B. | (CH3 CH2)2 CHCH3 | ||
| C. | (CH3)2 CH CH (CH3)2 | D. | (CH3)3 C CH2CH3 |
分析 某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代产物,则说明该有机物的一氯代物有3种;根据等效氢原子来判断各烷烃中氢原子的种类,有几种类型的氢原子就有几种一氯代物,据此进行解答.
解答 解:A.(CH3)2CHCH2CH2CH3中有5种位置不同的氢,所以其一氯代物有5种,能生成5种沸点不同的产物,故A错误;
B.(CH3 CH2)2 CHCH3中有4种位置不同的氢,所以其一氯代物有4种,能生成4种沸点不同的产物,故B错误;
C.(CH3)2CHCH(CH3)2含有2种等效氢,所以能生成2种沸点不同的有机物,故C错误;
D.(CH3)3CCH2CH3中有3种位置不同的氢,所以其一氯代物有3种,能生成3种沸点不同的产物,故D正确.
故选D.
点评 本题考查了常见有机物的同分异构体的判断,难度不大,为高频考点,侧重于学生的分析能力的考查,注意掌握书写同分异构体的方法,明确判断有机物分子中等效氢原子的方法:①分子中同一甲基上连接的氢原子等效;②同一碳原子所连甲基上的氢原子等效;③处于镜面对称位置(相当于平面成像时,物与像的关系)上的氢原子等效.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
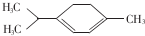 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
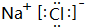 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 | |
| B. | 教材上铝热反应实验中KClO3的作用是使镁带剧烈燃烧 | |
| C. | 石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

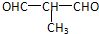 +4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.
+4Cu(OH)2+2NaOH$\stackrel{△}{→}$NaOOCCH(CH3)COONa+2Cu2O↓+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 |  |
| D | Ba(OH)2 | 金刚石 | 玻璃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com