为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(1)甲同学认为X中除Fe
3+外还可能含有Fe
2+.若要确认其中的Fe
2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)
取少量X溶液装于试管,向试管中滴加酸性高猛酸钾溶液,若溶液褪色,则证明X溶液中含有Fe2+,否则不含Fe2+
取少量X溶液装于试管,向试管中滴加酸性高猛酸钾溶液,若溶液褪色,则证明X溶液中含有Fe2+,否则不含Fe2+
.
供选用试剂:a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO
4溶液
(2)乙同学为了测定气体Y中SO
2的含量,设计如下三种方案:
方案Ⅰ.取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl
2溶液,经适当操作后得干燥固体4.66g.
方案Ⅱ.向VmL c mol?L
-1酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色.
方案Ⅲ,取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg.
①其中不合理的方案是
方案III
方案III
,理由是
生成BaCO3和BaSO4两种沉淀,无法计算SO2的体积
生成BaCO3和BaSO4两种沉淀,无法计算SO2的体积
.
②选择合理方案的数据计算气体Y中SO
2的体积分数(用含未知数的代数式表示)
.
[探究二]分析上述实验中SO
2体积分数的结果,丙同学认为气体Y中还可能含量有H
2和CO
2气体.为此设计了下列探究实验装置(图中夹持装置已省略).
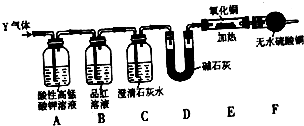
(3)装置A中试剂的作用是
吸收并除去SO2
吸收并除去SO2
.
(4)简述确认气体Y中含有CO
2的实验现象:
B中品红溶液不褪色,C中澄清石灰水变浑浊
B中品红溶液不褪色,C中澄清石灰水变浑浊
.
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?
不可靠
不可靠
(填“可靠”或“不可靠”),简述理由:
空气中的水蒸气进入F装置,也可使无水硫酸铜变蓝色
空气中的水蒸气进入F装置,也可使无水硫酸铜变蓝色
.

 科学实验活动册系列答案
科学实验活动册系列答案
 某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.
某化学兴趣小组的学生从网上查得如下信息:①钠能在CO2中燃烧.②常温下CO能与PdCl2溶液反应得到黑色的Pd.经过分析讨论,他们认为钠在CO2中燃烧时,还原产物可能是碳,也可能是CO,氧化产物可能是Na2CO3.为验证上述推断,他们设计如下方案进行实验,请回答下列问题.