
亚硝酸钠广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂,它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生被当食盐误食的事件。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置,利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)

查阅资料:
①HNO2为弱酸,室温下存在反应3HNO2==HNO3+2NO↑+H2O;
②NO2-能被很多常见的强氧化剂氧化,如在酸性溶液中可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
④HNO2在酸性溶液也是一种氧化剂,如能把I-氧化成I2。
⑤AgNO2是一种难溶于水易溶于酸的白色化合物。
(1)写出C中制备亚硝酸钠反应的化学方程式(反应物的物质的量之比为2:1) 。
(2)D装置的作用是 。
(3)经检验C产物中亚硝酸钠含量较少。甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。为排除干扰甲同学在B、C装置间增加装置E,E中盛放的试剂应是________(写名称)。
(4)人体正常的血红蛋白中含Fe2+。若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是 。
A亚硝酸盐是还原剂
B维生素C是还原剂
C维生素C将Fe3+还原Fe2+
D亚硝酸盐被还原
(5)能用来鉴别NaNO2和NaCl的方法是
A 测溶液pH法
B.加酸法
C.AgNO3和HNO3两种试剂法
D.加KI淀粉(酸性)法
E.以上四种方法都可
(6)某同学把溴水加到NaNO2溶液观察到溴水褪色,请写出此反应的离子方程式 。
(1)2NO + Na2O2 =2NaNO2 (2)除去未反应的NO,防止污染空气
(3)碱石灰 (4)A (5)E
(6)NO2- +Br2 +H2O=NO3-+2Br-+2H+
【解析】(1)Na2O2有强氧化性,而NO有还原性,所以二者会发生氧化还原反应,2NO + Na2O2=2NaNO2
(2)NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸,所以答案是除去未反应的NO,防止污染空气
(3)有碳酸钠和氢氧化钠,说明气体中混有二氧化碳和水蒸汽,所以加入碱石灰来除去干扰。
(4)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,所以A 错误。
(5)亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A可以;加酸,可以让NO2-+H+=HNO2,HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O,一氧化氮遇到氧气生成红棕色的二氧化氮,而氯化钠没有现象,故B可以;亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故C可以;在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故D可以;综上所述,所以选E;
(6)观察到溴水褪色,说明溴水被亚硝酸钠还原,再根据生成了NaNO3和HBr,反应的离子方程式是:NO2- +Br2+H2O=NO3-+2Br-+2H+ 。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是

A.a点对应的溶液中:Na+、Fe3+、SO42- 、HCO3-
B.b点对应的溶液中:Ag+、Ca2+、NO3- 、F-
C.c点对应的溶液中:Na+、S2-、SO42- 、Cl-
D.d点对应的溶液中:K+、NH4+ 、I-、 CO32-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
下列有关化学用语表示正确的是
A.乙醛的结构简式:CH3COH
B.H2O2的电子式:
C.次氯酸的电子式: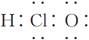
D.亚硫酸钠水解的离子方程式:SO32-+2H2O H2SO3+2OH-
H2SO3+2OH-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
某课外实验小组设计的下列实验不合理的是


A装置①制备并观察氢氧化亚铁 B.装置②证明过氧化钠与水反应放热


C.装置③比较KMnO4、Cl2、 D.装置④测定盐酸的浓度
I2的氧化性强弱
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
有关下列装置的叙述不正确的是


A.图①铝片发生的电极反应式是:Al+4OH--3e-===AlO2-+2H2O
B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+===Fe2++H2↑
C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.图④充电时,阳极反应是:PbSO4+2H2O-2e-===PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列说法不正确的是
A.矿物油的主要成分是烃类物质,植物油的主要成分是酯类物质
B.医学中用斐林试剂检验尿液中是否含葡萄糖时利用了葡萄糖的还原性
C.CH3-CH2-CH2-CH3分子中的四个碳原子一定不在同一直线上
D.分子组成为C8Hl0的芳香族化合物有3种
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
容器中发生一个化学反应,反应过程中存在H2O、H2S、S、NH4+、H+、NO3—六种物质。在反应过程中测得NO3—和S的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是

A.配平后氧化剂与还原剂的化学计量数之比为1:4
B.硫元素在反应中被还原
C.还原剂是含NH4+的物质
D.若生成1molNH4+,则转移电子2mol。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列图示与对应的叙述相符的是
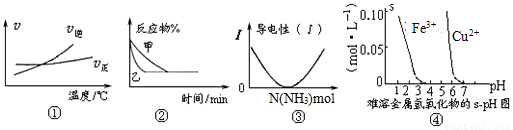
A.根据图①可判断可逆反应A2(g)+3B2(g) 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,乙的压强大
3C(g)+D(g)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.据图④,若除去0.1mol·L-1 CuSO4溶液中混有的Fe3+,可向溶液中加入适量NaOH至pH约为7
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合4 题型:简答题
工业上以黄铜矿(主要成分CuFeS2)为原料制备金属铜,有如下两种工艺。
I.火法熔炼工艺,将处理过的黄铜矿加人石英,再通人空气进行焙烧,即可制得粗铜。
(1)焙烧的总反应式可表示为2CuFeS2+ 2SiO2+5O2=2Cu+2FeSiO3+4SO2该反应的氧化剂是 。
(2)下列处理SO2的方法,不合理的是_____
A高空排放 B用纯碱溶液吸收制备亚硫酸钠
C用氨水吸收后,再经氧化制备硫酸铵 D用BaCl2溶液吸收制备BaSO3
(3)炉渣主要成分有FeO、Fe2O3、SiO2、Al2O3等,为得到Fe2O3加盐酸溶解后,后续处理过程中,未涉及到的操作有 。
A过滤 B加过量NaOH溶液 C蒸发结晶 D灼烧 E加氧化剂
II. FeCl3溶液浸取工艺其生产流程如下图所示

(4)浸出过程中,CuFeS2与FeCl3溶液反应的离子方程式为_____________。
(5)该工艺流程中,可以循环利用的物质是 (填化学式)。
(6)若用石墨电极电解滤液,写出阳极的电极反式_____________。
(7)黄铜矿中含少量Pb,调节C1一浓度可控制滤液中Pb2+的浓度,当c(C1一)=2mo1·L-1时,溶液中Pb2+物质的量浓度为 mol·L-1。[已知KSP(PbCl2)=1 x 10一5]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com