
| A. | 在反应2 H2S+SO2→3 S+2 H2O中被氧化与被还原的硫原子的质量 | |
| B. | 相同温度下,0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 CH3COOH溶液中的c(H+) | |
| C. | 在密闭容器中,N2+3H2?2NH3达平衡时的c(NH3)与c(N2) | |
| D. | Na2CO3晶体中Na+与CO32-离子个数比 |
分析 A.该反应中硫化氢中硫原子被氧化,二氧化硫中硫原子被还原;
B.醋酸为弱酸,醋酸的浓度大小影响电离程度,醋酸浓度越大,电离程度越小;
C.该反应为可逆反应,题中数据无法计算平衡时氨气与氮气的浓度关系;
D.碳酸钠晶体中,钠离子与碳酸根离子的数目之比为2:1.
解答 解:A.在反应2 H2S+SO2→3S+2 H2O中,H2S为还原剂,反应中被氧化,SO2为氧化剂,反应中被含有,则该反应中被氧化与被还原的硫原子的质量之比为2:1,故A正确;
B.相同温度下,0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 CH3COOH溶液中,前者醋酸浓度大于后者,则前者溶液中醋酸的电离程度较小,前后两溶液中的c(H+)之比小于2:1,故B错误;
C.在密闭容器中N2+3H2?2NH3达平衡,由于缺少必要数据,如反应物初始浓度、转化率等,则无法计算c(NH3)与c(N2)的比值,故C错误;
D.Na2CO3晶体中,碳酸根离子不水解,则Na+与CO32-离子个数比为2:1,故D正确;
故选AD.
点评 本题考查较为综合,涉及氧化还原反应、弱电解质的电离、盐的水解原理及可逆反应特点等知识,题目难度不大,注意掌握浓度对电离平衡的影响,明确氧化剂、还原剂的概念及判断方法,试题培养了学生的分析能力及灵活应用能力.


 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:实验题
 在2L的密闭容器中,高温下发生下列反应:
在2L的密闭容器中,高温下发生下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
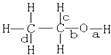
| A. | 和乙酸发生酯化反应键a断裂 | |
| B. | 和浓硫酸共热至170℃时键b和d断裂 | |
| C. | 在铜催化和加热条件下和氧气反应键a、c断裂 | |
| D. | 和氢溴酸反应键a断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 | |
| B. | 将苯酚晶体放入少量水中,加热时全部溶解,冷却到50℃形成悬浊液 | |
| C. | 苯酚的酸性很弱,不能使指示剂变色,但可以和NaHCO3反应放出CO2 | |
| D. | 苯酚也可以与硝酸发生硝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
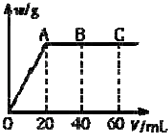 有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).
有H2SO4和HCl 的混合溶液20mL,加入0.025mol•L-1 Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液pH=7).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶于盐酸:CaCO3+2 H+→Ca2++H2O+CO2↑ | |
| B. | 氯水滴加到碘化钾溶液中:Cl2+I-→I2+Cl- | |
| C. | 铁和硫酸铜溶液反应:Fe+Cu2+→Fe2++Cu | |
| D. | 醋酸溶液和氢氧化钾溶液混合:CH3COOH+OH-→CH3COO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com