
| ||
| ||


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
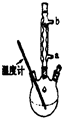 乙酰水杨酸俗称阿司匹林(
乙酰水杨酸俗称阿司匹林(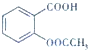 ),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
),是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: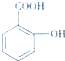 +(CH3CO)2O
+(CH3CO)2O| 浓硫酸 |
| 85℃-90℃ |
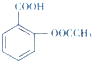 +CH3COOH
+CH3COOH| 浓硫酸 |
| 摇匀 |
| 85℃-90℃加热 |
| 冷却 |
| 减压过滤 |
| 洗涤 |
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
| 乙酸乙酯 |
| 沸石 |
| 加热 |
| 回流 |
| 趁热过滤 |
| 冷却 |
| 减压过滤 |
| 洗涤 |
| 干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
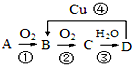 已知A、B、C、D之间存在如图转化关系,试回答下列问题:
已知A、B、C、D之间存在如图转化关系,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y被还原,X2+是氧化产物 |
| B、Y被还原,X发生还原反应 |
| C、X是还原剂,Y被氧化 |
| D、X被氧化,X显氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com