
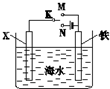
| A. | 若X为Zn时,则开关K置于M或N时均可减缓铁的腐蚀 | |
| B. | 若X为Cu时,为减缓铁的腐蚀,开关K应置于M处 | |
| C. | 若X为石墨、开关K置于M时,X电极上的反应为2H++2e-=H2↑ | |
| D. | 若X为石墨、开关K置于N时,铁电极上的反应为Fe-2e-=Fe2+ |
分析 根据金属的防护,若K置于N处,形成电解池,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,金属铁为正极,金属铁被保护.
解答 解:A、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,若K置于N处,铁为阴极,金属铁被保护,故A正确;
B、若X为Cu时,开关K应置于M处,形成原电池,此时金属铁为负极被腐蚀,故B错误;
C、若X为石墨,开关K置于M处,形成原电池,此时金属铁为负极,正极X电极上的反应为02+4e-+H2O=4OH-,故C错误;
D、若X为石墨,开关K置于N处,形成电解池,X极为阳极,铁为阴极,铁电极上的反应为2H++2e-=H2↑,故D错误.
故选A.
点评 本题考查了原电池和电解池原理,明确原电池正负极和电解池阴阳极上发生的电极反应是解本题关键,难点是电极反应式的书写,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
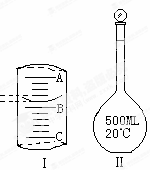 实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:
实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2→H2SiO3 | B. | Na2O2→Na2CO3 | C. | Fe→FeCl2 | D. | Al2O3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

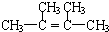
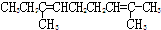 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +(a+b)kJ•mol-1 | B. | +(a-b)kJ•mol-1 | ||
| C. | +(a+3b)kJ•mol-1 | D. | +(0.5a+1.5b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4 | B. | C2H6 | C. | C2H2 | D. | C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉可长期放置在烧杯中 | |
| B. | 金属钠燃烧时不能用水灭火,应该用沙子灭火 | |
| C. | 氯水可以用无色透明的试剂瓶装保存 | |
| D. | 实验后剩余的钠不可放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com