
分析 (1)根据MnO2+4HCl═MnCl2+Cl2↑+2H2O计算参加反应的盐酸的物质的量;
(2)被氧化的HCl生成氯气,根据氯原子守恒计算被氧化的HCl,再根据m=nM计算.
解答 解:(1)设参加反应的盐酸的物质的量为nmol,生成氯气为mmol,
则 MnO2+4HCl═MnCl2+Cl2↑+2H2O
87 4 1
8.7g n m
解得n=0.4mol,m=0.1mol
答:参加反应的盐酸的物质的量为0.4mol;
(2)被氧化的HCl生成氯气即生成0.1mol氯气,所以根据氯原子守恒可知,被氧化的HCl为0.1mol×2=0.2mol,故被氧化的HCl的质量为0.2mol×36.5g/mol=7.3g,
答:被氧化的HCl的质量为7.3g.
点评 本题考查了氧化还原反应的计算,明确物质间的关系是解本题关键,根据关系式进行解答即可,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铁片上:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| C. | 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-═AgCl↓+NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系压强保持不变 | B. | 混合气体颜色保持不变 | ||
| C. | SO3和NO的体积比保持不变 | D. | 每消耗1molSO3的同时生成1molNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雾是溶液,能永久在空气中稳定存在 | |
| B. | 雾的胶体,一段时间内能稳定存在 | |
| C. | 雾是乳浊液,不能稳定存在 | |
| D. | 雾的悬浊液,在空气中能沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
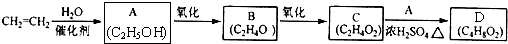
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g O2中含有的氧分子数为NA | |
| B. | 1mol Zn变为Zn2+时失去的电子数目为NA | |
| C. | 常温常压下,11.2 L H2中含有的氢分子数为0.5NA | |
| D. | 1L 1 mol•L-1 BaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com