
(14分)X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3:8,X的原子序数是Z的原子序数的一半。
(1)Y在周期表中的位置是________;X的氢化物与P的氢化物接近时的现象是_________。
(2)W与P可形成原子个数比为1:2的化合物,其电子式为__________。
(3)Y与P形成的化合物溶液显____性;用离子反应方程式表示显这种性质的原因________________。
(4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是______________________(填化学式)。
(5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。写出此三氟化物与水反应的化学反应方程式_____,若0.6mol X的三氟化物完全与水反应,则转移的电子总数约为_________个。
(1)第三周期第ⅢA族;产生大量白烟 (2)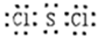
(3)酸;Al3++3H2O Al(OH)3+3H+ (4)HCl H2S SiH4
Al(OH)3+3H+ (4)HCl H2S SiH4
(5)3NF3+5H2O═2NO↑+HNO3+9HF;2.408×1023
【解析】
试题分析:X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大,Y、Z、W、P位于同一周期,X元素形成的单质是自然界中含量最多的气体,则X是N元素;1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,能和盐酸、氢氧化钠溶液反应且放出气体的物质只有Al,所以Y是Al元素;W的原子最外层电子数与核外电子总数之比为3:8,W的原子序数大于13,且为短周期元素,所以其最外层电子数与其核外电子总数分别是6、16,则W是S元素;X的原子序数是Z的原子序数的一半,所以Z是Si元素,P为短周期主族元素,且原子序数大于16,所以P是Cl元素。
(1)铝元素的原子序数是16,在周期表中的位置是第三周期第ⅢA族;氨气与氯化氢混合迅速反应生成氯化铵,产生大量白烟。
(2)S与Cl可形成原子个数比为1:2的化合物为SCl2,每个氯原子形成1个共用电子对、硫原子形成2个共用电子对,所以其电子式为 。
。
(3)Y与P形成的化合物是氯化铝,其溶液显酸性,是由于铝离子水解导致的,离子方程式为Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
(4)元素非金属性越强,其氢化物越稳定,同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以其氢化物越稳定,因此Si、S、Cl三种元素的气态氢化物稳定性由高到低的顺序是 HCl>H2S>SiH4。
(5)NCl3在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色,说明生成NO,同时还生成硝酸和氢氟酸,该反应的化学方程式为3NF3+5H2O═2NO↑+HNO3+9HF,根据NCl3与转移电子之间的关系式得,转移电子数=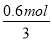 ×1×(5?3)NA/mol=2.408×1023。
×1×(5?3)NA/mol=2.408×1023。
考点:考查元素推断、元素周期律的应用、水解、常见化学用语书写以及氧化还原反应的计算等


科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:填空题
(6分)将3 mol A和3 mol B混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g)  xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,C的平均反应速率为0.1 mol/(L·min)。试求:
(1)B的平均反应速率为 。
(2)x的值为 。
(3)5 min后,A、B的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:选择题
在容积为2 L的恒容的密闭容器中,一定温度下,发生反应:aM(g)+bN(g) cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
cQ(g)。气体M、N、Q的物质的量随时间的变化如图所示,则下列叙述正确的是( )
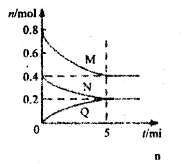
A.该温度下此反应的平衡常数的值K=25/4
B.该反应前5 min的平均速率:v(N)=0.002 mol·L-1·min-1
C.在5 min时,再向体系中充入少量He,重新达到平衡前v(正)>v(逆)
D.若开始时向容器中充入2mol M和1mol N,达到平衡时,M的体积分数小于50%
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三年级总复习质量检测三理综化学试卷(解析版) 题型:实验题
(18分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
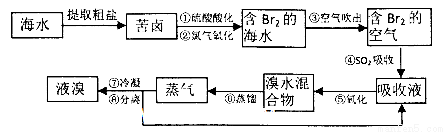
(1)氯元素在周期表中位于_______ 周期_______族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是________ 。
(3)步骤④利用了SO2的还原性,反应的离子方程式为_________ __。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90℃温度过高或过低都不利于生产,请解释原因____________________________.
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是__________。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,这样操作的意义是__________。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三年级总复习质量检测三理综化学试卷(解析版) 题型:选择题
下列化学过程及其表述正确的是
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性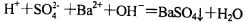
B.由水电离的c(H+)为l0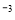 mol
mol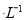 的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存
的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存
C.酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性
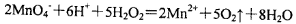
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三二模考试理综化学试卷(解析版) 题型:选择题
下列与有机物结构、性质相关的叙述中,正确的是
A.煤油是石油的分馏产品,可用于保存少量金属钠
B.肥皂可以通过高分子化合物油脂发生皂化反应制得
C.鸡蛋清中加入CuSO4溶液会产生盐析现象,析出的蛋白质可再溶于水
D.淀粉、纤维素完全水解的产物互为同分异构体,且都可与新制氢氧化铜反应
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
有0.1 mol 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,C(CH3COO-)=C(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+)
D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:填空题
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。 请完成下列填空:
(1)10Be和9Be 。(填序号)
a.具有相同的化学性质 b.Be 元素的近似相对原子质量是9.5
c.具有相同的中子数 d.通过化学变化可以实现10Be和9Be间的相互转化
(2)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是 。(填序号)
a.比较这两种元素的单质的硬度和熔点
b.将空气中放置已久的这两种元素的单质分别和热水作用
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
(3)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序 (用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干操剂,此化合物的电子式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
某有机物的结构简式为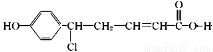 其不可能发生的反应有
其不可能发生的反应有
①加成反应 ②还原反应 ③消去反应 ④氧化反应
⑤水解反应 ⑥中和反应 ⑦与稀盐酸反应
A.②③④ B.①④⑥ C.③⑤⑦ D.⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com