
【题目】“反向燃烧”可将二氧化碳变为燃料。回答下列问题:

(已知甲烷的标准燃烧热ΔH=-890 kJ·mol-1) 。
(1)科学家用氮化镓材料与铜组装如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。
①写出铜电极表面的电极反应式:_________________________;
②该总反应的热化学方程式为:___________________________,
(2)利用CO2与H2反应可制备CH4。
已知氢气的标准燃烧热ΔH=-286 kJ·mol-1 ;H2O(g) = H2O (l),ΔH=-44kJ·mol-1;
则二氧化碳与氢气反应生成甲烷和水蒸气的热化学方程式为_____________________;
该反应能自发的条件是__________(填高温或低温)。
【答案】CO2+8e-+8H+=CH4+2H2O CO2(g)+2H2O(l)=CH4(g)+2 O 2(g)△H=+890kJ·mol-1 CO2(g)+ 4H2(g)=CH4(g)+ 2H2O(g)△H=﹣166kJ·mol-1 低温
【解析】
(1)由电池装置图可知,在太阳光作用下形成原电池,电池工作时是将太阳能转化为电能的过程,铜的表面发生还原反应,CO2得电子与氢离子反应生成甲烷;原电池的总反应为甲烷燃烧的逆过程,能量变化为吸热,以此分析。
(2)写出方程式CO2(g)+ 4H2(g)=CH4(g)+ 2H2O(g),根据盖斯定律结合已知的热化学方程式求出反应热;根据△H-T△S<0,分析反应条件。
(1)①由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;
因此,本题正确答案是:CO2+8e-+8H+=CH4+2H2O;
②该原电池负极反应为4H2O-4e-=8H++2O 2↑,则总反应为:CO2+2H2O=CH4+2O 2,该反应为甲烷燃烧的逆过程,能量变化为吸热,根据甲烷的标准燃烧热ΔH=-890 kJ·mol-1,可得该总反应的热化学方程式为:CO2(g)+2H2O(l)=CH4(g)+2 O 2(g)△H=+890kJ·mol-1,
因此,本题正确答案是:CO2(g)+2H2O(l)=CH4(g)+2 O 2(g)△H=+890kJ·mol-1。
(2)根据已知①CO2(g)+2H2O(l)=CH4(g)+2 O 2(g)△H=+890kJ·mol-1,
②H2(g)+![]() O2(g)=H2O(l) △H=-286kJ·mol-1,
O2(g)=H2O(l) △H=-286kJ·mol-1,
③ H2O(g) = H2O (l),ΔH=-44kJ·mol-1;
根据盖斯定律,①+②![]() 4-③
4-③![]() 2,得到CO2(g)+ 4H2(g)=CH4(g)+ 2H2O(g)
2,得到CO2(g)+ 4H2(g)=CH4(g)+ 2H2O(g)
△H=+890 kJ·mol-1+(-286 kJ·mol-1)![]() 4﹣(-44 kJ·mol-1)
4﹣(-44 kJ·mol-1)![]() 2=﹣166kJ·mol-1 ,
2=﹣166kJ·mol-1 ,
根据△H-T△S<0时,反应能够自发进行,该反应为放热反应,ΔH<0,气体分子数减小,ΔS<0,所以,低温有利于反应自发进行,
因此,本题正确答案是:CO2(g)+ 4H2(g)=CH4(g)+ 2H2O(g)△H=﹣166kJ·mol-1;低温。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】工业上生产环氧乙烷(![]() )的反应为:2 CH2=CH2(g) +O2(g)
)的反应为:2 CH2=CH2(g) +O2(g)![]() 2
2![]() (g) ΔH=-106 kJ·mol-1,其反应机理如下:①Ag+O2
(g) ΔH=-106 kJ·mol-1,其反应机理如下:①Ag+O2![]() AgO2 慢
AgO2 慢
②CH2=CH2+AgO2![]()
![]() +AgO 快
+AgO 快
③CH2=CH2+6AgO![]() 2CO2+2H2O+6Ag 快
2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是
A. 反应的活化能等于106 kJ·mol-1
B. AgO2也是反应的催化剂
C. 增大乙烯浓度能显著提高环氧乙烷的生成速率
D. 理论上0.7 mol乙烯参与反应最多可得到0.6 mol环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,如图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
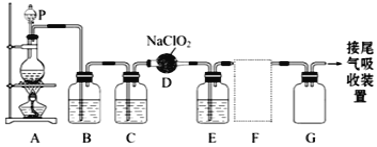
(1)仪器P的名称是___。
(2)实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应,写出D中发生反应的方程式:___。
(3)B装置中所盛的试剂是___。
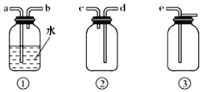
(4)F为ClO2收集装置,应选用的装置是___(填序号),其中与E装置导管相连的导管口是___(填接口字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像描述正确的是

A. 图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化
B. 根据图②可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
C. 图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的锌粉发生反应产生氢气的体积(V)随时的变化的示意图
D. 图④可表示压强对可逆反应A(g)+B(g)![]() 2C(g)+D(g)的影响,乙的压强大
2C(g)+D(g)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨的形成是一种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如下:

下列有关说法错误的是( )
A. 光照能引发酸雨的形成
B. 所涉及的变化均为氧化还原反应
C. 污染空气能加快酸雨的形成
D. 优化能源结构能有效遏制酸雨污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. HClO电离 HClO=ClO-+H+
B. CuSO4水解 Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
C. NaHCO3电离 NaHCO3![]() Na++HCO3-
Na++HCO3-
D. KF水解 Fˉ+H2O![]() HF+OHˉ
HF+OHˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四碘化锡(Snl4,M=627g/mol)是一种橙色针状晶体,遇水易发生水解,可在非水溶剂中由Sn和l2直接化合得到,实验装置如图(1)(加热装置略去)所示。

实验步骤如下:
组装仪器并加入药品后,通入冷凝水,加热圆底烧瓶,控制反应温度在80℃左右,保持回流状态,直到反应完全。取下仪器A、B,趁热将溶液倒入干燥的烧杯中,用热的CCl4洗涤圆底烧瓶内壁和锡片,并将洗涤液合并入烧杯内。再将烧杯置于冷水浴中冷却即析出Snl4晶体。
请回答下列问题:
(1)仪器B的名称为___________,冷凝水的进口为____________(填“甲”或“乙”)。为了控制反应温度,对圆底烧瓶适宜的加热方式是____________________。
(2)仪器A中盛放的试剂为无水CaCl2,其作用为____________。
(3)反应完全的现象为__________,用热的CCl4洗涤圆底烧瓶内壁和锡片的目的是_______,从烧杯中获取产品的操作名称为______________。
(4)产品的纯度可用滴定法测定:称取m g产品,加入足量的水,使产品充分水解[SnI4+(2+x)H2O=SnO2·xH2O↓+4HI]。将上层清液全部定容于250mL容量瓶中。移取25.00mL于锥形瓶中,加入少量CCl4和几滴KSCN溶液,用c mol/L的标准FeCl3溶液滴定至终点,平行测定三次,平均消耗标准FeCl3溶液的体积为1mL。(已知:2Fe3++2I-![]() 2Fe2++I2)
2Fe2++I2)
①下列关于滴定分析,不正确的是________。
a.图(2)中为避免滴定管漏液,应将凡士林涂在旋塞的a端和旋塞套内的c端
b.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶的内壁
c.当下层溶液变为紫红色且半分钟不褪色即为滴定终点
d.若不加CCl4,则测得样品的纯度可能偏高
②产品纯度的表达式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
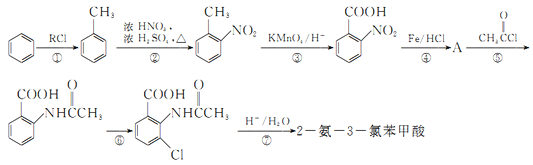
已知:
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
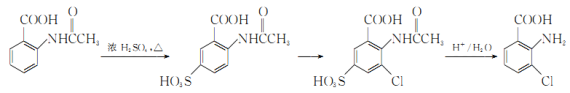
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液滴入某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如图所示[已知:![]() ]。下列叙述不正确的是
]。下列叙述不正确的是

A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液的过程中,![]() 保持不变
保持不变
C. m点所示溶液中:c(H+)+c(Na+)=c(HA)+c(OH-)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com