
| ���� | H2CO3 | H2SO3 | HClO |
| ����ƽ�ⳣ�� ��25�棩 | Ki1=4.30��10-7 Ki2=5.61��10-11 | Ki1=1.54��10-2 Ki2=1.02��10-7 | Ki=2.95��10-8 |
| A�� | NaHSO3��Һ�е�����Ũ�ȴ�СΪ��c��Na+����c��HSO3-����c��H+����c��SO32-����c��OH-�� | |
| B�� | ��ͬ�¶�ʱ������Һ��pH��ϵ��Na2CO3��NaClO��Na2SO3 | |
| C�� | ClO-+CO2+H2O=HClO+HCO3- | |
| D�� | 2ClO-+SO2+H2O=2HClO+SO32- |
���� A��NaHSO3��Һ��������������ӵ�ˮ��̶�С�ڵ���̶ȣ���Һ��ʾ���ԣ�
B�������ε�ˮ����ɣ�Խ��Խˮ����������ˮ��õ��������ǿ�����ش�
C����ѧ��Ӧ��ѭǿ���Ʊ������ԭ����
D����ѧ��Ӧ��ѭǿ���Ʊ������ԭ�������Ǵ�������������ԣ�
��� A��NaHSO3��Һ��������������ӵ�ˮ��̶�С�ڵ���̶ȣ���Һ��ʾ���ԣ����ڣ�c��Na+����c��HSO3-����c��H+����c��SO32-����c��OH-������A��ȷ��
B�����ݱ������ݣ��õ�����˳����HCO3-��HClO��HSO3-�������ε�ˮ����ɣ�Խ��Խˮ�⣬����ˮ��̶ȣ�HCO3-��HClO��HSO3-������˳���ǣ�Na2CO3��NaClO��Na2SO3����B��ȷ��
C�����ԣ�H2CO3��HClO����ѧ��Ӧ��ѭǿ���Ʊ������ԭ������Ӧ��ClO-+CO2+H2O=HClO+HCO3-�ܷ�������C��ȷ��
D����������������ԣ��ܽ����������������Ϊ��������ӣ���D����
��ѡD��
���� ���⿼���ˡ���Һ�е���غ�������ʵĵ��롢ˮ��ԭ����Ӧ�õ�֪ʶ����Ŀ�����ڻ���֪ʶ��Ӧ�ã���Ŀ�ۺ��Խ�ǿ���Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
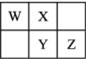 W��X��Y��Z���ֶ�����Ԫ����Ԫ�����ڱ��е����λ����ͼ��ʾ��W����̬�⻯���������ۺ����ᷴӦ�������ӻ�����ɴ˿�֪��������
W��X��Y��Z���ֶ�����Ԫ����Ԫ�����ڱ��е����λ����ͼ��ʾ��W����̬�⻯���������ۺ����ᷴӦ�������ӻ�����ɴ˿�֪��������| A�� | YԪ���������Ӧˮ���������һ������Z | |
| B�� | W��X��Y������⻯���ȶ�����ǿ����X | |
| C�� | XԪ���γɵĵ��������ӻ�ԭ�Դ���Y | |
| D�� | ZԪ�ص����ڻ�ѧ��Ӧ��ֻ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ԭ��������Y��2��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2����
��ԭ��������Y��2��Ԫ�ص�һ���⻯���ֽܷ�Ϊ������һ���⻯��˷ֽⷴӦ�Ļ�ѧ����ʽ��2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ǻ���ɫ�ģ�C1-����ɫ�� | |
| B�� | H2��C12���ܰ���ȼ�գ�����ʲ�ɫ��ƿ���а�ɫ�������� | |
| C�� | Cl2��H2�Ļ����һ���ᷢ����ը | |
| D�� | ȼ��ʱһ��Ҫ�������μ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.12 | B�� | 2.24 | C�� | 3.36 | D�� | 4.48 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ҵ��������Ĺ�����ʹ�ù���������������߶��������ת���� | |
| B�� | �ϳɰ���ҵ��ʹ�ô����������NH3�IJ��� | |
| C�� | ����ɫ��NO2��ѹ����ɫ�ȱ����ٱ�dz | |
| D�� | CO2��g��?CO2��aq����H��0��������ѹ�����������̼������ˮ�е��ܽ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com