
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2L三氯甲烷中含有氯原子的数目为1.5NA
B.90g葡萄糖中含氧原子数目为3NA
C.常温下,1L 0.5mol·L1醋酸铵溶液(pH=7)中CH3COO与![]() 数目均为0.5NA
数目均为0.5NA
D.1mol Na2O和1mol Na2O2组成的混合物中含有的离子总数为7NA
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
CO2(g)+H2(g) ΔH<0。CO和H2O的浓度变化如图所示。
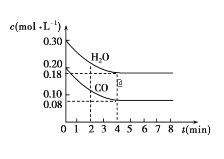
请解答下列各题:
(1)0~4min内的平均反应速率v(CO)=___mol/(L·min),v(H2)=___mol/(L·min),v(CO2)=___mol/(L·min)。
(2)请你在图中标出CO2和H2的浓度变化。___
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表。
时间(min) | 0 | 2 | 3 | 4 | 5 | 6 |
CO | 0.200 | 0.138 | c1 | c1 | 0.116 | 0.096 |
H2O | 0.300 | 0.238 | c2 | c2 | 0.216 | 0.266 |
CO2 | 0 | 0.062 | c3 | c3 | 0.084 | 0.104 |
H2 | 0 | 0.062 | c4 | c4 |
①表中3min~4min之间,反应处于___状态;c1___0.08mol/L(填“大于”、“小于”或“等于”)。
②反应在4min~5min之间,平衡向逆反应方向移动,可能的原因是___(单选),表中5min~6min之间数值发生变化,可能的原因是___(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室干馏煤的装置图,结合下图回答问题。

(1)指出图中仪器名称:a__________;b__________;c__________;d__________。
(2)装置c的作用是____________________________________,d中的液体有________和________。有机物可以通过________的方法使其中的重要成分分离出来。
(3)e处点燃的气体是________,火焰的颜色是________色。
(4)下列叙述错误的是________。
A.煤发生了化学变化
B.d中液体显碱性
C.d中液体不分层
D.e处的气体可以还原氧化铜,也可以使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是( )
A.2Na+2H2O═2NaOH+H2↑B.CaCO3+2HCl═CaCl2+H2O+CO2↑
C.2KClO3![]() 2KCl+3O2↑D.CH4+2O2
2KCl+3O2↑D.CH4+2O2![]() CO2+2H2O
CO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Pt极电解含有Ag+、Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m (g)与回路中通过电子的物质的量n (mol)关系如图所示。则下列氧化性强弱的判断正确的是

A. Ag+>X3+>Cu2+>H+>X2+
B. Ag+>Cu2+>X3+>H+>X2+
C. Cu2+>X3十>Ag十>X2+>H+
D. Cu2+>Ag+>X3+>H+>X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是氮循环的一部分:

(1)通常状况下,NO2的颜色是__________;
(2)反应①的化学方程式是________________________________;
(3)NO2易溶于水,并和水发生化学反应。该反应中,氧化剂是_________;
(4)化合物A的化学式是_______________;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:
2NO + 2CO = 2CO2 + N2。当生成2mol N2时,被还原的NO为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E原子序数依次增大。已知:A、C同主族,A的原子最外层电子数是次外层的3倍,B的氧化物既能溶于强酸,又能溶于强碱,D的原子半径是第3周期中最小的,E是形成骨骼和牙齿的主要元素,且E单质能和水反应。则下列分析错误的是
A.A和 B形成的化合物可作为耐火材料
B.A和C的氢化物的沸点:C>A
C.简单离子半径:E<D<C
D.E和D形成的化合物的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醇是一种重要的化工原料,广泛用于香料、造纸、制药和印染等行业。实验室制备苯甲醇的反应原理和有关数据如图:
2 +K2CO3+H2O→2
+K2CO3+H2O→2 +CO2↑+2KCl
+CO2↑+2KCl

实验步骤:如图所示,在装有电动搅拌器的250mL三颈烧瓶里加入9.0g碳酸钾(过量),70.0mL水,加热溶解,再加入2.0mL四乙基溴化铵[(CH3CH2)4NBr]溶液和10.0mL氯化苄。搅拌加热回流反应1~1.5h。反应结束后冷却,并转入125mL分液漏斗中,分出有机层,水层用萃取剂萃取三次。合并萃取液和有机层,加入无水硫酸镁固体,静置、过滤。最后进行蒸馏纯化,收集200~208℃的馏分,得8.4mL苯甲醇。

回答下列问题:
(1)仪器X的名称是_________,冷却水应从_________(填“上口”或“下口”)通入。
(2)本实验中加入无水硫酸镁的目的是_________。从绿色化学角度考虑,萃取剂宜采用___(填字母)。
A.乙醇 B.乙酸乙酯 C.苯 D.氯仿
(3)某同学认为该装置中的电动搅拌器可以换成沸石,以防暴沸。该说法______(填“是”或“否”)正确,其理由是_______________。
(4)四乙基溴化铵没有直接参与反应,但大大提高了反应速率,其原因可能是____________。
(5)本实验苯甲醇的产率为______%(计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是重要的化工原料,可以用来制备硝酸以及各种化肥产品.
(1)氨分子的电子式为_____.
(2)写出一水合氨的电离方程式_____;现在在10 mL 0.1 mol/L的一水合氨溶液中滴加0.1mol/L的盐酸,若要使在常温下混合溶液的pH=7,那么需要滴加盐酸溶液的体积_____10ml(选填大于、等于、小于)
(3)用两根玻璃棒,一根蘸取浓氨水,一根蘸取浓硫酸,当两根玻璃棒靠近时,出现的现象是_____;该反应的化学方程式为_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com