
 中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注. ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
分析 (1)As的原子结构示意图有4个电子层,最外层有5个电子,与N同族,故位于第四周期,VA族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,As电子层数比N多2,非金属性N>As;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,以As2O5(s)为始态,As(s)、5/2 O2( g)为终态,由图可知:△H+|△H1|=|△H2|,据此计算;
(4)碱浸过程中没有元素化合价的变化,过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,烘干,发生反应的离子方程式为2AsO43-+2SO2+2H+═As2O3+2SO42-+H2O,酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率.
解答 解:(1)As的原子结构示意图有4个电子层,最外层有5个电子,位于第四周期,VA族,
故答案为:第四周期,VA族;
(2)元素非金属性越强,对应氢化物的热稳定性越好,最高价氧化物对应水化物的酸性越强,非金属性N>As,①NH3的热稳定性比AsH3好,②HNO3的酸性比H3AsO4强③As电子层数比N多2,N的原子半径比As的原子半径小,
故答案为:②③;
(3)根据盖斯定律可知,反应热与过程无关,只与始态、终态有关,以As2O5(s)为始态,As(s)5/2O2( g)为终态,由图可知:△H+|△H1|=|△H2|,△H=|△H2|-|△H1|=914.6kJ/mol-619.2kJ/mol=+295.4kJ/mol,
故答案为:As2O5(s)═As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(4)①碱浸过程中没有元素化合价的变化,
故答案为:不是;
②过程Ⅲ为溶液到固体,需要经过浓缩结晶,过滤,洗涤,干燥,
故答案为:浓缩结晶,过滤,洗涤,烘干;
③过程Ⅲ发生反应的离子方程式为2AsO43-+2SO2+2H+═As2O3+2SO42-+H2O,酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率,
故答案为:2AsO43-+2SO2+2H+═As2O3+2SO42-+H2O;酸性越强,物质的氧化性或者还原性可能增强;增加氢离子浓度平衡正向移动促进反应的进行,有利于提高As2O3的产率.
点评 本题考查原子结构,元素非金属性与物质稳定性、酸性的关系,半径的比较,根据盖斯定律进行反应热的计算,可以根据反应进行图写出各步热化学方程式,利用热化学方程式构造目标热化学方程式计算,实验的综合应用能力,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 | |
| B. | 加热蒸发CuCl2饱和溶液得纯净的CuCl2晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4g NaHCO3固体中含有的阴阳离子总数为0.2 NA | |
| B. | 标准状况下,22.4L苯中含有的分子数为NA | |
| C. | 通常状况下,NA 个甲烷分子占有的体积为22.4L | |
| D. | 1L物质的量浓度为1mol/L的Na2CO3溶液中,含有CO32-个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
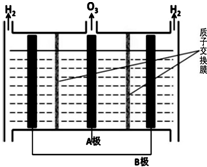
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
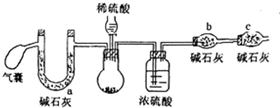 过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:
过氧化钠可做航天飞船的供氧剂,对其纯度要求很高,某小组同学为了测定过氧化钠的纯度(杂质为碳酸钠),设计了如下方案:| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2O>HF>H2S | B. | 原子半径:Na>Mg>O | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 金属性:Na>Mg>Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在平衡体系PCl3(g)?PCl3+Cl2(g)中加入一定量的${\;}_{\;}^{37}$Cl,达到平衡后”37Cl仅存在于五氯化鱗和氯气分子里,不可能存在于三氯化磷分子 | |
| B. | CH3C00H与H180-CH2CH3;发生酯化反应化是可逆反应,达到平衡后${\;}_{\;}^{18}$0仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里 | |
| C. | CH2Br2没有同分异构体的事实证明了甲烷分子是碳原子为中心的正四面体结构 | |
| D. | 在氧气中完全燃烧后生成物只有C02和H2O的有机物不一定是烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com