
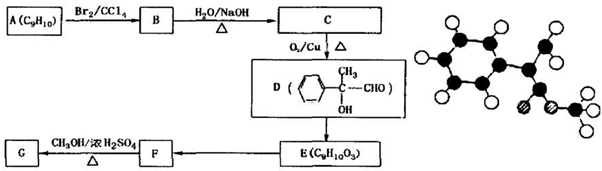
 表示(其中X、Y均不为H),且能发生银镜反应的物质有
表示(其中X、Y均不为H),且能发生银镜反应的物质有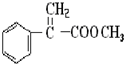 ,A的分子式为C9H10,不饱和度为5,结构D的结构可知A为
,A的分子式为C9H10,不饱和度为5,结构D的结构可知A为 ,A与溴发生加成反应生成B为
,A与溴发生加成反应生成B为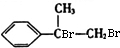 ,B发生水解反应生成C为
,B发生水解反应生成C为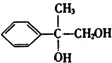 ,C发生催化氧化生成D,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构
,C发生催化氧化生成D,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构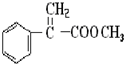 ,可知D中的醛基被氧化为羧基而生成E为
,可知D中的醛基被氧化为羧基而生成E为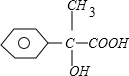 ,根据G的结构可知,F为
,根据G的结构可知,F为 ,E发生消去反应生成F,F与甲醇通过酯化反应反应的G,据此解答.
,E发生消去反应生成F,F与甲醇通过酯化反应反应的G,据此解答.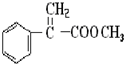 ,A的分子式为C9H10,不饱和度为5,结构D的结构可知A为
,A的分子式为C9H10,不饱和度为5,结构D的结构可知A为 ,A与溴发生加成反应生成B为
,A与溴发生加成反应生成B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C发生催化氧化生成D,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构
,C发生催化氧化生成D,根据D、E的分子式可知,E比D多1个O原子,再结合G的结构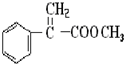 ,可知D中的醛基被氧化为羧基而生成E为
,可知D中的醛基被氧化为羧基而生成E为 ,根据G的结构可知,F为
,根据G的结构可知,F为 ,E发生消去反应生成F,F与甲醇通过酯化反应反应的G,
,E发生消去反应生成F,F与甲醇通过酯化反应反应的G,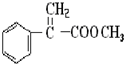 ,G的分子式为C10H10O2,G中环状基团被氢原子取代后的有机物为CH2=CHCOOCH3,名称为丙烯酸甲酯,
,G的分子式为C10H10O2,G中环状基团被氢原子取代后的有机物为CH2=CHCOOCH3,名称为丙烯酸甲酯, ;D为
;D为 ,含有官能团的名称为羟基、醛基,
,含有官能团的名称为羟基、醛基, ;羟基、醛基;
;羟基、醛基;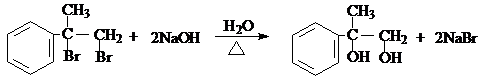 ;
;
| 浓硫酸 |
| △ |
 +H2O,
+H2O,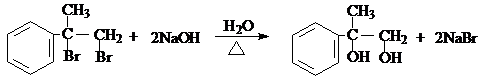 ;
;
| 浓硫酸 |
| △ |
 +H2O;
+H2O; )的同分异构体中可用通式
)的同分异构体中可用通式 表示(其中X、Y均不为H),含有2故相同的取代基,且能发生银镜,则含有-CHO,若为2个-OH,另外取代基为-CH2CH2CHO或-CH(CH3)CHO,若为2个-CH2OH,另外取代基为-CHO,若为2个-OCH3,另外取代基为-CHO,故符合条件的同分异构体共有4种,其中核磁共振氢谱有6个峰的物质结构简式为:
表示(其中X、Y均不为H),含有2故相同的取代基,且能发生银镜,则含有-CHO,若为2个-OH,另外取代基为-CH2CH2CHO或-CH(CH3)CHO,若为2个-CH2OH,另外取代基为-CHO,若为2个-OCH3,另外取代基为-CHO,故符合条件的同分异构体共有4种,其中核磁共振氢谱有6个峰的物质结构简式为: ,
, .
.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| A、Cl2+H2O═HCl+HClO |
| B、KClO3+6HCl═KCl+3Cl2↑+3H2O |
| C、2FeCl3+H2S═2FeCl2+S↓+2HCl |
| D、2H2O2═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol?L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较H2SiO3和H2CO3的酸性强弱 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②③⑤ | D、②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com