
下列有机物的命名正确的是( )
A.2,2二甲基3丁烯
B.2,3二甲基3乙基丁烷
C.3,3,5,5四甲基己烷
D.2甲基1,3丁二烯
科目:高中化学 来源: 题型:
1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度不变、恒容的容器中进行反应H2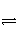
 2H ΔH>0,若反应物的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需反应时间应为( )
2H ΔH>0,若反应物的浓度由0.1 mol·L-1降到0.06 mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需反应时间应为( )
A.10 s B.12 s C.大于12 s D.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
将2 mol I2(g)和1 mol H2置于某2 L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)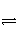
 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
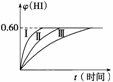
(1)达到平衡时,I2(g)的物质的量浓度为__________。
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是________(填入下列条件的序号,下同),乙条件可能是__________。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L的密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有4种碳骨架如下的烃,下列说法正确的是( )
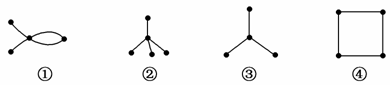
A.①和④互为同素异形体
B.②和③互为同系物
C.①和④都能发生加成反应
D.只有②和③能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列4种物质:
A.CH2===CHCH2C(CH3)3
B.CH2ICH===CHCH2I
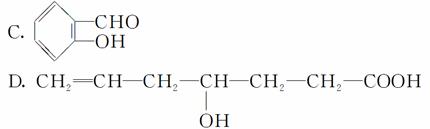
(1)属于烃的是__________________。
(2)属于卤代烃的是__________________。
(3)既属于醛又属于酚的是____________________。
(4)既属于醇又属于羧酸的是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的是
( )。
A.16O2与18O2互为同分异构体
B.16O与18O核外电子排布方式不同
C.通过化学变化可以实现16O与18O间的相互转化
D.标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
( )。
A.为提高农作物的产量和质量,应大量使用化肥和农药
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.实现化石燃料清洁利用,就无需开发新能源
D.垃圾是放错地方的资源,应分类回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
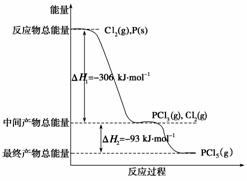
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达到平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
________________________________________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com