
【题目】乙酸乙酯是无色具有水果香味的液体,沸点为77.2 ℃,实验室某次制取乙酸乙酯用醋酸14.3 mL、95%乙醇23 mL,还用到浓硫酸、饱和碳酸钠以及极易与乙醇结合的氯化钙溶液。主要装置如图所示:

实验步骤:
①先向A中的蒸馏烧瓶中注入少量乙醇和浓硫酸后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗里待用。这时分液漏斗里醋酸和乙醇的物质的量之比约为5∶7。
②加热油浴保温约135~145 ℃。
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加入速率使蒸出酯的速率与进料速率大体相等,直到加料完成。
④保持油浴温度一段时间,至不再有液体馏出后,停止加热。
⑤取下B中的锥形瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边振荡,至无气泡产生为止。
⑥将⑤的液体混合物分液,弃去水层。
⑦将饱和CaCl2溶液(适量)加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品。
试回答:
(1)实验中浓硫酸的主要作用是_____。
(2)用饱和Na2CO3溶液洗涤粗酯的目的是______。如果用NaOH溶液代替Na2CO3溶液将引起的后果是____。
(3)用饱和CaCl2溶液洗涤粗酯的目的是_____。
(4)在步骤⑧所得的粗酯里还含有的杂质是____。
【答案】催化剂和吸水剂 与挥发出来的乙酸反应、溶解挥发出来的乙醇,降低乙酸乙酯的溶解度 使挥发出来的乙酸乙酯水解而使实验失败 除去乙醇 水
【解析】
(1)酯化反应中浓硫酸起到催化作用和吸水作用;
(2)饱和碳酸钠溶液能与乙酸反应除去乙酸、溶解乙醇、同时降低乙酸乙酯的溶解度,便于分层;乙酸乙酯在强碱性条件下发生水解反应;
(3)乙醇和氯化钙会能形成络合物,饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇;
(4)饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中还含有水。
:
(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,又因为该反应为可逆反应,浓硫酸吸水后利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂和吸水剂,故答案为:催化剂和吸水剂;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,同时溶解挥发出来的乙醇,这样更便于闻乙酸乙酯的香味;降低乙酸乙酯在水中的溶解度,便于分层得到乙酸乙酯;由于乙酸乙酯在强碱性条件下发生水解反应使最终得不到乙酸乙酯,使实验失败;故答案为:与挥发出来的乙酸反应、溶解挥发出来的乙醇,降低乙酸乙酯的溶解度;使挥发出来的乙酸乙酯水解而使实验失败;
(4)由于乙醇和氯化钙会能形成络合物,故可以用饱CaCl2溶液来吸收乙酸乙酯中可能残留的乙醇,故答案为:除去乙醇;
(5)饱和碳酸钠溶液除掉了乙酸和乙醇,饱和CaCl2溶液可以进一步吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中还含有杂质水,故答案为:水。


科目:高中化学 来源: 题型:
【题目】某同学设计了蔗糖与浓硫酸反应的改进装置,并对气体产物进行检验,实验装置如图所示。下列结论中正确的是( )
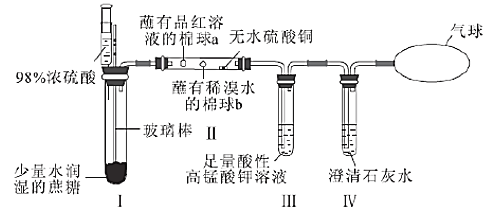
选项 | 现象 | 结论 |
A. | Ⅰ中注入浓硫酸后,可观察到试管中白色固体变为黑色 | 体现了浓硫酸的吸水性 |
B. | Ⅱ中观察到棉球a、b都褪色 | 均体现了SO2的漂白性 |
C. | Ⅱ中无水硫酸铜变蓝 | 说明反应产物中有H2O |
D. | Ⅲ中溶液颜色变浅,Ⅳ中澄清石灰水变浑浊 | 说明有CO2产生 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
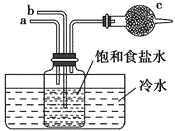
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒锂锂离子电池具有较大的比容量、低廉的价格等优点。一种钒锂锂离子二次电池的结构示意图如图,其负极反应为:CmLin-xe-=CmLin-x+xLi+(CmLin表示锂原子嵌入石墨形成的复合材料),放电时的总反应为:CmLin+LiV3O8=CmLin-x+Li1+xV3O8。
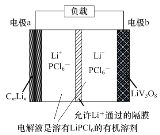
下列说法正确的是( )
A.放电时Li+由正极区移向负极区
B.充电时电极a与外接电源的正极相连
C.充电时阳极为Li1+xV3O8-xe-=LiV3O8+xLi+
D.正极质量每增加2.1g,电路中转移的电子数为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入物质,发生反应:PCl3(g)+Cl2(g)![]() PCl5(g) ΔH<0,测得反应的相关数据如下:
PCl5(g) ΔH<0,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
温度/℃ | 200 | 300 | 200 |
起始物质投入量 | 1molPCl3、2molCl2 | 2molPCl3、1molCl2 | 2molCl2、2molPCl5 |
平衡c(PCl5)/mol·L-1 | c1 | c2 | c3 |
化学平衡常数 | K1 | K2 | K3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(PCl3) | α2(Cl2) | α3(PCl5) |
下列说法正确的是( )
A.K1<K2
B.c1<c2
C.p3=2p1
D.α1(PCl3)+α3(PCl5)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
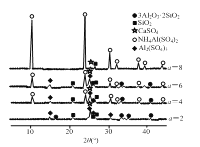
【题目】以粉煤灰(主要含3Al2O3·2SiO2、SiO2,还含有少量CaO、Fe2O3等物质)为原料制取Al2O3的流程如图:
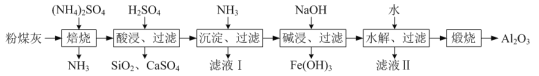
(1)当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=![]() )不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
)不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
(2)“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3的离子反应方程式为___。
(3)“碱浸”加入NaOH发生反应的离子方程式为___。
(4)“水解、过滤”可得到Al(OH)3沉淀,升高温度有利于水解的原因是___。该步骤可将加水改成通入过量的___气体。
(5)流程中,可以回收并循坏利用的物质除NH3外,还有___和___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。任务1:利用如图所示装置探究NO2能否被NH3还原(夹持固定装置已略去)。
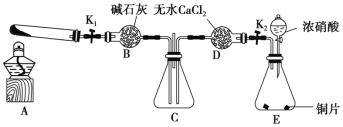
请回答下列问题:
(1)E装置中制取NO2的化学方程式是_____________________________。
(2)此实验装置存在的一个明显缺陷是_______________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(3)实验前,该小组同学提出三种假设。
假设1:二者不反应;假设2:NO2能被Na2O2氧化;
假设3:________________________________________________。
(4)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

①装置的合理连接顺序是(某些装置可以重复使用)_________________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
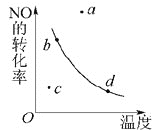
A.a点B.b点C.c点D.d点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com