
 a Z(g) + W(g) ��H =��QkJ��mol��1 (Q>0)
a Z(g) + W(g) ��H =��QkJ��mol��1 (Q>0)| A��2 molX��1mol Y��1molAr | B��a molZ��1mol W |
| C��1 molX��0.5mol Y��0.5a molZ��0.5 mol W | D��4 molX��2mol Y |




| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)(����ӦΪ���ȷ�Ӧ)��Ϊ��ʹƽ�������ɰ��ķ����ƶ����ɲ��õķ�����
2NH3(g)(����ӦΪ���ȷ�Ӧ)��Ϊ��ʹƽ�������ɰ��ķ����ƶ����ɲ��õķ�����| A������ѹǿ | B����Сѹǿ | C�������¶� | D��ʹ�ô��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g) �ﵽƽ��ı�־��
2C(g) �ﵽƽ��ı�־���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
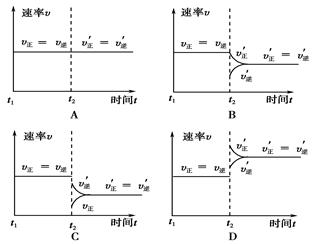
| A��������������緢���Ƚ��� |
| B����������ƽ����Է����������ֲ��� |
| C����V(N2)?��V(H2)��?V(NH3)��1��?3?��2ʱ |
| D����������������ٷ����仯ʱ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g����H
CH3OH��g����H| �¶� | 250��C | 300��C | 350��C |
| K | 2��041 | 0��270 | 0��012 |
| ���� | �� | �� | �� | |
| ��Ӧ��Ͷ���� | 1molCO��2moL H2 | 1molCH3OH | 2molCH3OH | |
| ƽ�� ʱ�� ���� | CH3OHŨ�ȣ�mol/L�� | c1 | c2 | c3 |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ��ϵѹǿ��Pa�� | p1 | p2 | p3 | |
| ��Ӧ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 | 0 | 500 | 1000 |
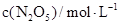 | 5.00 | 3.52 | 2.48 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 PCl5(g)�ﵽƽ��ʱ�� PCl5Ϊ0.40 mol�������ʱ����1.0 molPCl3��0.50 molCl2������ͬ�¶����ٴ�ƽ��ʱ PCl5�����ʵ�����( )
PCl5(g)�ﵽƽ��ʱ�� PCl5Ϊ0.40 mol�������ʱ����1.0 molPCl3��0.50 molCl2������ͬ�¶����ٴ�ƽ��ʱ PCl5�����ʵ�����( )| A��0.40 mol | B��С��0.20 mol |
| C��0.20 mol | D������0.20 mol����0.40 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Cu��s����CO2��g������֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
Cu��s����CO2��g������֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�| �¶�/�� | 1 000 | 1 150 | 1 300 |
| ƽ�ⳣ�� | 4��0 | 3��7 | 3��5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com