
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 二核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |

 .;
.; .
. 分析 根据原子核数和带电荷数可知a为Na+,e为OH-,I为NH3,物质A由a、e 构成,应为NaOH,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,能与NaOH反应的工业生成为工业制备漂白液的反应,为Cl2和NaOH的反应,则B为Cl2,C为H2,D为N2,H为HCl,反应④应为工业电解饱和食盐水,则E为NaClO,M为HClO,见光分解生成氧气,则K为O2,和O2反应生成NO和H2O,则G为H2O,J为NO,F为NaCl,E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,反应的方程式为NaOCl+2NH3=N+NaCl+H2O,根据质量守恒可知N为N2H4,L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,因H为HCl,则L含有C、O、Cl三种元素,结合质量守恒可知L应为COCl2,反应的方程式为COCl2+2NH3=CO(NH2)2+2HCl,结合物质的性质以及题目要求可解答该题.
解答 解:根据原子核数和带电荷数可知a为Na+,e为OH-,I为NH3,物质A由a、e 构成,应为NaOH,B、C、D、K都是单质,反应①-⑤都是用于工业生产的反应,能与NaOH反应的工业生成为工业制备漂白液的反应,为Cl2和NaOH的反应,则B为Cl2,C为H2,D为N2,H为HCl,反应④应为工业电解饱和食盐水,则E为NaClO,M为HClO,见光分解生成氧气,则K为O2,和O2反应生成NO和H2O,则G为H2O,J为NO,F为NaCl,E(溶液)能与I以1:2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,反应的方程式为NaOCl+2NH3=N+NaCl+H2O,根据质量守恒可知N为N2H4,L是由3种元素构成的分子,能与I以1:2的物质的量之比反应生成尿素CO(NH2)2和物质H,因H为HCl,则L含有C、O、Cl三种元素,结合质量守恒可知L应为COCl2,反应的方程式为COCl2+2NH3=CO(NH2)2+2HCl,
(1)由以上分析可知B为Cl2,F为NaCl,其电子式为 ,
,
故答案为:Cl2; ;
;
(2)H+E(溶液)→M的反应是盐酸和NaClO反应生成次氯酸,反应的离子方程式为:H++ClO-═HClO,
故答案为:H++ClO-═HClO;
(3)I为NH3,K为O2,I与K反应的电子转移方向和数目为 ,
,
故答案为: .
.
点评 本题考查无机物的推断,题目难度较大,本题注意把握常见工业反应以及反应原理,为解答该题的关键,注意反应的条件以及生成物的种类,结合质量守恒定律判断生成物并书写相关反应的方程式,解析要求学生熟练掌握常见10电子的微粒,熟悉常见化学工业生产重要反应.


科目:高中化学 来源: 题型:选择题
| A. | 硫离子的结构示意  | B. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | ||
| C. | 明矾的化学式:KAlSO4•12H2O | D. | CO2的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中加NaNO3溶液 | B. | 向稀盐酸中加碳酸钠固体 | ||
| C. | 将锌粒制成薄片 | D. | 向稀盐酸中加食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 人们回收废旧电池主要是为了防止重金属对水土的污染 | |
| C. | 氢氧燃料电池的能量转化率可达100% | |
| D. | 太阳能电池的主要材料为二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )| A. | X原子可能为第VA族元素 | |
| B. | 该分子中既含有极性共价键又含有非极性共价键 | |
| C. | Y 原子可能为第ⅠA 族或第ⅦA 族元素元素 | |
| D. | 从圆球的大小分析,该分子可能为 N2F4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
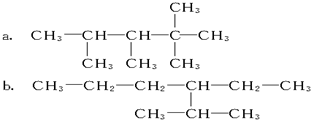
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com