
能说明醋酸是弱电解质的是
| A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液 |
| B.用食醋可以除热水瓶内的水垢 |
| C.pH=2的醋酸溶液稀释1000倍后pH小于5 |
| D.用浓H2SO4和醋酸钠固体共热可制得醋酸 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.100℃时,KW =10-12,此温度下PH =6的溶液一定显酸性 |
| B.25℃时,0.1mol/L的NaHSO3溶液pH =4,说明HSO3-在水溶液中只存在电离 |
| C.NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 |
| D.25℃时,10mL 0.1mol/L CH3COOH溶液与5mL 0.1mol/L NaOH溶液混合,所得溶液中有 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃时,0.1mol·L-1CH3COONa溶液pH=a,则
| A.该温度下,CH3COOH的Ka=1014-2a |
| B.该温度下,上述溶液中水的电离度α=(1.8×l0 a -14)% |
| C.升高温度,溶液中c(H+)增大,水解平衡常数K也增大 |
| D.加水稀释,CH3COONa水解程度增大,C(OH-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对“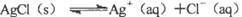 ”的理解正确的是( )。
”的理解正确的是( )。
| A.说明AgCl没有完全电离,AgCl是弱电解质 |
| B.说明溶解的AgCl已完全电离,AgCl是强电解质 |
| C.说明Ag+与Cl-的反应不能完全进行到底 |
| D.说明Ag+与Cl-的反应可以完全进行到底 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]
B.已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH="1"
D.室温下,0.1mol?L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列应用与盐类的水解无关的是( )
| A.纯碱溶液可去除油污 |
| B.NaCl可用作防腐剂和调味剂 |
| C.TiCl4溶于大量水加热制备TiO2 |
| D.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表是五种银盐的溶度积常数(25 ℃):
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将氨水滴加到盛有AgCl浊液的试管中,AgCl逐渐溶解,再加入NaBr溶液又产生了浅黄色沉淀。对上述过程,下列理解或解释中正确的是( )
| A.Ksp(AgCl)<Ksp(AgBr) |
| B.若在AgCl浊液中直接加入NaBr溶液,也会产生浅黄色沉淀 |
| C.上述实验说明AgCl没有NaBr稳定 |
| D.因为Ksp(AgCl)>Ksp(AgOH),故氨水能使AgCl溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com